Источником чистой культуры дрожжей могут быть лабораторные коллекционные культуры, производственные субстраты и естественные экологические ниши.
Чистой микробной культурой называют популяцию, представляющую собой потомство одной или нескольких клеток одного вида микроорганизма.
Каждый новый изолят носит название штамма, которому присваивают буквенное или номерное обозначение.
Расами называют производственные штаммы одного вида дрожжей, различающиеся между собой по степени проявления физиологической активности.
В генетических исследованиях пользуются так называемыми клонами – чистыми культурами, полученными от одной споры или гаплоидной клетки.
Основной задачей при исследовании любого материала является получение чистой культуры, т. е. изолированных колоний тех организмов, которые находятся в субстрате. При этом важнейшим условием успешной работы является правильный выбор последовательности ее выполнения и подбор необходимых питательных сред.
Существуют прямые и непрямые методы получения чистых культур дрожжей.
Первые основаны на выделении одной клетки или споры под непосредственным контролем через микроскоп.
Во втором случае используют косвенные приемы для разделения клеток.
8.1.1. КАПЕЛЬНЫЙ СПОСОБ ЛИНДНЕРА
Суспензию дрожжей разбавляют жидким суслом до концентрации ≈100 клеток в 1 мл и стерильным чертежным пером наносят мельчайшие капельки на необезжиренное покровное стекло, простерилизованное фламбированием в пламени горелки. Капельки располагают в определенном порядке, обычно по 5 капель в два ряда, т. е. всего 10 капель на стекле. Затем быстро опрокидывают стекло над влажной камерой, которую запечатывают минеральной смазкой. Все капли немедленно просматривают под микроскопом и отмечают те из них, которые содержат по одной-единственной клетке. Если все капли содержат по несколько клеток, то увеличивают разбавление суспензии и процедуру повторяют. После трех-, четырехдневного инкубирования, когда отмеченные единичные клетки образуют микроколонии, последние переносят стерильной иглой или полоской стерильной фильтровальной бумагой в жидкую среду и инкубируют.
8.1.2. МЕТОД ЛИНДНЕРА, УПРОЩЕННЫЙ ВУЧКОВИЧЕМ
Видоизменение Вучковичем метода Линднера сводится к тому, что капельки суспензии, содержащие 3–4 клетки дрожжей, снимают петлей, которой предварительно захватывают стерильную среду, и переносят штрихом на поверхность плотной среды. Через некоторое время появляются микроколонии, число которых на одном штрихе должно соответствовать количеству исходных клеток в отмеченной капельке. Из этих колоний пересевом выделяют чистые культуры. Таким способом можно сразу получить несколько одноклеточных культур за короткое время.
8.1.3. ВЫДЕЛЕНИЕ СПОР ДРОЖЖЕЙ ПРИ ПОМОЩИ МИКРОМАНИПУЛЯТОРА
К использованию микроманипулятора прибегают главным образом при необходимости изолировать споры из асков, так как вегетативные клетки легко повреждаются при микроманипулировании. Аски разрывают либо механическим прикосновением игл микроманипулятора, либо заранее обрабатывая суспензию препаратом ферментов (например, из пищеварительного тракта виноградной улитки Helix pomatia), лизирующих клеточную стенку дрожжей.
В эту группу включают методы, основанные на разделении клеток в питательных средах и использовании специфических биологических особенностей отдельных видов для создания преимущественных условий для их роста.
Основным методом выделения чистых культур микроорганизмов является метод, предложенный Р. Кохом. Принцип его заключается в получении чистой культуры из изолированной колонии.
На поверхность плотных питательных сред из пипетки наносят каплю накопительной культуры или ее разведения в стерильной воде и стерильным стеклянным шпателем Дригальского распределяют каплю по поверхности среды в чашке Петри (рис. 20). Далее этим же шпателем протирают поверхность среды последовательно во второй, третьей и четвертой чашках. Обычно в первых двух чашках после инкубации наблюдается сплошной рост микроорганизмов, тогда как в последующих – рост изолированных колоний.
Рассевать накопительную культуру можно бактериологической петлей методом истощающего штриха. В этом случае накопительную культуру или ее разведение отбирают петлей и на поверхности плотной среды проводят штрихи в порядке, указанном на рисунке 21. Перед взятием каждого нового инокулята петлю стерилизуют над пламенем горелки.
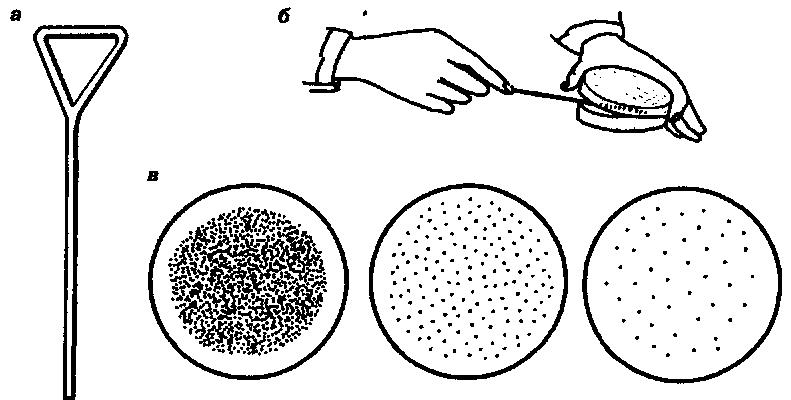
Рис. 20
Рассев культуры микроорганизмов на поверхность плотной питательной
среды шпателем Дригальского:
а – шпатель Дригальского; б – рассев; в – рост микроорганизмов.
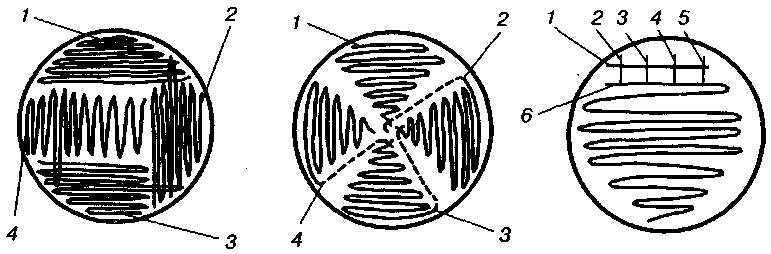
Рис. 21
Рассев культуры микроорганизмов на поверхность плотной питательной среды бактериологической петлей:
1–6 – последовательность контакта бактериологической петли с
поверхностью плотной питательной среды.
После посева чашки Петри помещают в термостат крышками вниз, чтобы конденсационная вода, образовавшаяся на крышке чашки при застывании агара и впоследствии при инкубации, не стекала на поверхность среды и не помешала получить изолированные колонии. Чашки выдерживают в термостате в течение 7–10 суток при температуре 28–30°С.
С целью сохранения культуры выросшие изолированные колонии отсевают петлей на поверхность скошенного 2,5%-ного сусло-агара в пробирки или в жидкое неохмеленное сусло (8% СВ).
Посев на скошенный агар производится бактериологической петлей методом истощающего штриха, начиная со дна пробирки.
Длительное хранение требует особого подбора среды и условий хранения биомассы, при которых культура сохранит свою физиологическую активность.
В зависимости от первичного источника выделения и интенсивности его обсеменения следует принимать решение об использовании накопительных (элективных) сред на стадии посевов первичного материала.
Внесение в питательные среды селективных компонентов, их качественный и количественный состав определяются интенсивностью и биологическим разнообразием обсеменения первоначального субстрата посторонней сопутствующей плесневой, дрожжевой и бактериальной микрофлорой. При выделении дрожжей из сильно загрязненных субстратов и подавления роста сопутствующих микроорганизмов к указанным выше питательным средам добавляют различные ингибиторы селективного действия.
Рост большинства бактерий и актиномицетов подавляется при низком значении рН среды, поэтому чаще всего среды для выделения дрожжей подкисляют до рН 4,5 путем добавления к ним минеральных или органических кислот. Для синтетических сред наиболее применима соляная кислота, для сусловых – молочная, лимонная или винная. Для подкисления солодового сусла (8% СВ) обычно требуется концентрированной молочной кислоты 3–4 см3/л. Кислоты добавляют в жидкую или расплавленную агаровую среду после стерилизации, непосредственно перед засевом или перед разливкой в чашки Петри.
Вместо кислот используют также антибиотики широкого спектра действия: стрептомицин (80 мг/л или 100 ед/см3), пенициллин (20–100 ед/см3), левомицетин (50 мг/л) и др. Их можно добавлять в среду порознь и в комплексе. Например, против кислотоустойчивых бактерий применяют следующие смеси антибиотиков: пенициллин 60 ед/см3 + стрептомицина сульфат 100 ед/см3; левомицетин (хлорамфеникол) 20 мг/л + стрептомицина сульфат 20 мг/л + хлортетрациклин солянокислый 100 мг/л.
Для отделения сахаромицетов от других дрожжей добавляют 2,5% этилацетата и рН до 4,0 доводят уксусной кислотой. Затем чашки герметизируют. При этих условиях колонии сахаромицетов появляются первыми.
Росту дрожжей на питательных средах при высеве из исходного материала зачастую препятствуют грибы с широко распространяющимися по поверхности субстрата мицелиальными колониями. Они имеют общие с дрожжами потребности в источниках питания, устойчивы к низким значениям рН среды и нечувствительны к действию указанных выше противобактериальных антибиотиков. Для ограничения роста микромицетов в среду добавляют специфические вещества: дифенил (0,005–0,01%), бычью желчь (0,25–0,5%), теллурат калия (0,05–0,15% ), пропионат натрия (0,15–0,25%), или некоторые красители: бромкрезоловый пурпурный (0,0025% или 2,5 см3/л 1% раствора), бенгальский розовый (0,003%), кристаллический фиолетовый (0,001%).
Поскольку дрожжи являются факультативными анаэробами и не требуют особых условий аэрирования, для получения их изолированных колоний посевы из накопительной культуры или другого исследуемого материала лучше производить на поверхность 2,5%-ного сусло-агара и инкубировать в обычных условиях при 28–30°С.










