О росте микроорганизмов в естественных субстратах или в питательных средах судят по изменению количества их клеток или биомассы в единице объема. Методы определения этих показателей могут быть прямыми (подсчет клеток под микроскопом, взвешивание) или косвенными. Косвенные методы основаны на измерении параметров, величина которых зависит от количества или биомассы микроорганизмов (число колоний, выросших после посева суспензии клеток на питательную среду, рассеяние или поглощение суспензией света, содержание в ней белка и т. д.). Выбор метода зависит от целей исследования, свойств питательной среды или субстрата, а также особенностей роста и морфологии микроорганизмов.
При оценке численности микроорганизмов, особенно в естественных субстратах, необходимо помнить, что их клетки часто находятся в прикрепленном (адгезированном) состоянии или в виде микроколоний. Поэтому перед началом подсчета их нужно отделить от частиц субстрата и друг от друга (десорбировать). Выбор метода десорбции (механическое перемешивание суспензии клеток, растирание, обработка ультразвуком, применение поверхностно-активных веществ и т. д.) определяется особенностями исследуемого субстрата.
Для подсчета клеток микроорганизмов под микроскопом можно использовать счетные камеры, препараты фиксированных и окрашенных клеток, приготовленные на предметных стеклах или мембранных фильтрах. Перечисленные методы позволяют определить общее количество клеток (как живых, так и мертвых) в единице объема. Основное ограничение большинства указанных методов – необходимость довольно высоких концентраций клеток в единице исследуемого субстрата.
В отличие от подсчета микроорганизмов под микроскопом, метод высева на питательные среды дает возможность определить только число жизнеспособных клеток в популяции.
Поскольку сред, пригодных для роста всех микроорганизмов, не существует, метод высева позволяет определить лишь число микроорганизмов, способных расти на среде данного состава. Это важно помнить при анализе таких естественных субстратов, как почва, вода и т. п.
Метод взвешивания биомассы широко применяют для оценки роста микроорганизмов в жидких питательных средах. Можно использовать его и для определения массы клеток, выращенных на плотной питательной среде, однако в этом случае микроорганизмы необходимо предварительно тщательно смыть с поверхности среды физиологическим раствором или водой и перевести в суспензию.
Оптический (нефелометрический, турбидиметрический) метод определения биомассы нашел широкое применение в лабораторных микробиологических исследованиях, поскольку позволяет быстро и довольно точно определить концентрацию клеток в суспензии или культуральной жидкости. В основе метода лежит измерение ослабления светового пучка при его прохождении через суспензию клеток. В определенных пределах оно обусловлено преимущественно рассеиванием света клетками пропорционально их концентрации. Величина этого показателя зависит от многих факторов (формы и размеров клеток, оптических свойств культуральной среды, длины волны света и т. д.), поэтому нефелометрический метод пригоден лишь для тех микроорганизмов, рост которых вызывает равномерное помутнение среды и не сопровождается заметным изменением формы и размеров клеток, образованием мицелия, пленок или других скоплений.
Чашечный метод требует особой чистоты и аккуратности при выполнении всех операций. Необходимо тщательно оберегать пипетки, пробирки и среды от заражения микроорганизмами из воздуха, так как каждая случайно попавшая клетка может заметно завысить число микроорганизмов в исследуемом субстрате.
Точность любого метода определения числа микроорганизмов ограничена ошибкой метода, которая возникает вследствие случайного распределения клеток в суспензии и является результатом ограниченного числа подсчитываемых клеток, а также связана с техническими ошибками, т. е. неточностью в приготовлении разведений, неправильным монтажом камеры, повторным учетом одной и той же клетки (колонии) и т. д. Ошибки метода неизбежны, тогда как технические ошибки зависят главным образом от качества работы исследователя. Следует помнить, что статистическая обработка результатов возможна только при минимальной технической ошибке.
Этот метод рекомендуется использовать для подсчета крупных объектов – дрожжей, одноклеточных водорослей, конидий грибов, некоторых относительно крупных бактерий. Наиболее распространенной является камера Горяева–Тома (рис. 23). Внешне она представляет собой толстое предметное стекло, разделенное бороздками. Центральная часть стекла содержит выемку глубиной 0,1 мм, на дно которой нанесена сетка. Глубина камеры – 0,1 мм, площадь больших квадратов сетки – 1/25 мм2, площадь малых квадратов – 1/400 мм2. Эти параметры указаны на предметном стекле.
При работе с камерой необходимо соблюдать определенные правила ее заполнения. Углубление с сеткой покрывают специальным шлифованным покровным стеклом и, слегка прижимая, двигают покровное стекло в противоположные стороны до появления картины интерференции (колец Ньютона), свидетельствующей о том, что стекло притерто к сторонам камеры. Только при таком условии объем камеры соответствует расчетному. После этого под кромку покровного стекла в центральной части камеры капилляром или пипеткой вносят суспензию исследуемых дрожжей. Заполненную камеру помещают на столик микроскопа. Подсчет клеток рекомендуется начинать через 2–3 мин после заполнения камеры, чтобы клетки осели, и при микроскопировании находились в одной плоскости.
Число клеток подсчитывают с объективом 40×. С иммерсионным объективом работать нельзя, так как его рабочее расстояние меньше толщины стекла камеры.
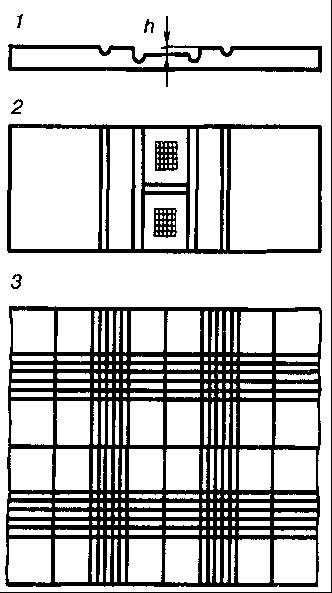
Рис. 23
Счетная камера Горяева-Тома:
1 – вид сбоку; 2 – вид сверху;
3 – при малом увеличении микроскопа; h – глубина камеры.
Обычно просчитывают клетки микроорганизмов в 10 больших или 20 малых квадратах сетки, следуя по диагонали. Учитывают все клетки, лежащие в квадрате сетки, а также пересекающие верхнюю и правую стороны квадрата. При подсчете число клеток в большом квадрате не должно превышать 20, а в малом – 10, в противном случае исходную суспензию разводят водопроводной водой. Для получения достоверного результата общее число подсчитанных клеток микроорганизмов должно быть не менее 600.
Подсчет клеток повторяют 3–5 раз, каждый раз заново монтируя камеру и заполняя ее суспензией микроорганизмов. Это обеспечивает большую точность, чем подсчет 600 клеток при однократном монтаже камеры. Количество клеток в 1 см3 исследуемой суспензии вычисляют по формуле
![]()
где М – количество клеток в 1 см3 суспензии; а – среднее количество клеток в квадрате сетки; h – высота камеры, мм; s – площадь квадрата сетки, мм2; 1000 – коэффициент перевода см3 в мм3; п – степень разведения исследуемой суспензии.
11.1.2. КАПИЛЛЯРНЫЙ МЕТОД ПРЯМОГО СЧЕТА МИКРООРГАНИЗМОВ
Для подсчета микроорганизмов Б. В. Перфильевым были разработаны специальные многоходовые счетные капилляры с плоскими параллельными стеклами. Они имеют прямоугольное сечение и по принципу подсчета аналогичны счетной камере, их глубина и ширина определяются конструкцией капилляра и представляют известные величины, а длина обычно соответствует диаметру поля зрения микроскопа или может быть измерена. В отличие от камеры Горяева, в капиллярах Перфильева можно использовать объективы с большим увеличением, в том числе иммерсионные, что позволяет подсчитывать мелкие микроорганизмы. Поэтому такие капилляры в принципе могут применяться для подсчета микробных клеток и контроля роста бактерий в промышленной, пищевой, а также медицинской микробиологии. Многоходовые капилляры представляют собой конструкцию из нескольких (обычно 5) параллельных капиллярных ячеек, смонтированных на специальном предметном стекле. Клетки микроорганизмов подсчитывают в каждой капиллярной ячейке, а для дальнейших расчетов используют усредненное число.
При погружении капилляра в субстрат он заполняется им в силу своих капиллярных свойств. Затем заливают конец капилляра расплавленным парафином, что позволяет предохранить содержимое капилляра от высыхания, помещают его на предметное стекло и подсчитывают клетки, используя объективы 40×, 90× или фазово-контрастное устройство.
Для получения достоверного результата подсчитывают клетки в 50–100 полях зрения, подсчет ведут во всех капиллярах. Количество клеток в 1 см3 исследуемого субстрата определяют по формуле
![]()
где М – количество клеток в 1 см3 суспензии; а – среднее количество клеток в капилляре длиной в диаметр поля зрения; h – глубина капилляра, мм; l – ширина капилляра, мм; d – диаметр поля зрения (длина капилляра) при данном увеличении микроскопа, мм; 1000 – коэффициент перевода см3 в мм3; п – степень разведения исследуемой суспензии.
11.1.3. КОМПЛЕКСНЫЙ ПОДСЧЕТ КЛЕТОК В СЧЕТНЫХ КАМЕРАХ***
При соблюдении всех правил работы со счетными камерами можно объединить в одном стекле несколько тестов. Это позволит существенно сэкономить время.
В пробирку внести 0,5–1,0 см3 дрожжевой взвеси и такое же количество раствора метиленового синего 1:40. Окрашенную суспензию выдержать 3–4 мин, тщательно перемешать и заправить ею счетную камеру.
При работе с камерой необходимо соблюдать правила ее заполнения и счета, описанные в пп. 11.1.1.
Число клеток подсчитывают с объективом 40×.
В приготовленной таким образом дрожжевой взвеси можно одновременно считать общее количество клеток, количество почкующихся клеток и мертвых почек, количество мертвых клеток в 1 см3 питательного субстрата.
Поскольку жидкость под покровным стеклом быстро высыхает, необходимо быстрое проведение и фиксирование результатов подсчета. Замедлить высыхание можно добавлением в окрашенную взвесь такого же количества 0,05%-ного водного раствора агара, что необходимо учесть в показателе п – степень разведения. В таком препарате возможно произвести и измерение размеров клеток. С этой целью лучше использовать капилляры Перфильева, применяя соответствующие правила подсчета.
Количество клеток в 1 см3 исследуемой суспензии вычисляют по формуле
![]()
где М – количество клеток в 1 см3 суспензии; а – среднее количество клеток в квадрате сетки;
h – высота камеры, мм; S – площадь квадрата сетки, мм2; 1000 – коэффициент перевода см3 в мм3;
п – степень разведения исследуемой суспензии; 2 – разведение раствором синьки.
Таблица 10
Характеристика клеток дрожжевой взвеси
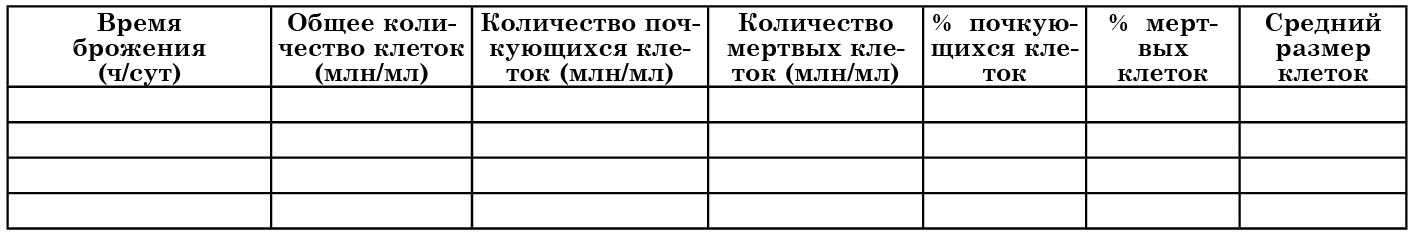
Результаты счета можно фиксировать в предлагаемой в качестве примера таблице 10.
11.1.4. ПОДСЧЕТ КЛЕТОК В ФИКСИРОВАННЫХ ОКРАШЕННЫХ ПРЕПАРАТАХ (МЕТОД ВИНОГРАДСКОГО–БРИДА)
Метод применяется в различных модификациях для определения численности микроорганизмов в разнообразных естественных субстратах – почве, загрязненной воде, оптически непрозрачных средах, содержащих нерастворимые в воде компоненты, например крахмал, муку и т. д. Преимущество метода заключается еще и в том, что фиксированные окрашенные препараты могут долго храниться, поэтому подсчет можно производить в удобное для исследователя время.
Хорошо обезжиренное предметное стекло помещают на миллиметровую бумагу, на которой размечен прямоугольник площадью 4 или 6 см2. Затем на стекло наносят точно отмеренный объем исследуемой суспензии (10, 20 или 30 мкл). В некоторых случаях добавляют каплю 0,03–0,1%-ного водного раствора агара. Нанесенную суспензию равномерно распределяют петлей по площади, отмеченной на миллиметровой бумаге. Препарат подсушивают на воздухе, фиксируют 10–20 мин абсолютным спиртом (96°) и окрашивают эритрозином, метиленовым синим, фуксином или другим красителем. Затем препарат промывают, последовательно погружая стекло в 4–5 сосудов с водой (промывать под проточной водой не следует) и высушивают на воздухе. В таком виде препараты хорошо сохраняются.
Препарат микроскопируют с иммерсионным объективом. При этом подсчитывают количество клеток в квадратах окулярной сетки, которую помещают в окуляр между собирательной и глазной линзами. При отсутствии сетки подсчитывают число клеток в поле зрения микроскопа. Правило подсчета в квадратах окулярной сетки то же, что и в квадратах сетки счетной камеры. Чтобы результат был достоверным, клетки микроорганизмов рекомендуется подсчитывать в 50–100 полях зрения. Общее количество подсчитанных клеток не должно быть менее 600. Количество клеток микроорганизмов в 1 см3 исследуемого субстрата вычисляют по формуле
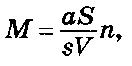
где М – количество клеток в 1 см3 суспензии; а – среднее количество клеток в квадрате окулярной сетки (поле зрения); S – площадь мазка, мм2; s – площадь квадрата окулярной сетки (поля зрения), мм2; V – объем нанесенной на стекло суспензии, см3; п – степень разведения исследуемой суспензии.
Площадь квадрата сетки, или поля зрения, определяют с помощью объект-микрометра, который помещают на столик микроскопа вместо препарата, и при том же увеличении, при котором проводили подсчет, определяют сторону квадрата окулярной сетки или диаметр поля зрения. Площадь поля зрения вычисляют по формуле
S = πr2.
11.1.5. ПОДСЧЕТ КЛЕТОК НА МЕМБРАННЫХ ФИЛЬТРАХ
Данный метод рекомендуется использовать для определения численности микроорганизмов в субстратах с низкой плотностью клеток. Его применяют при определении количества микроорганизмов в различных водоемах, при санитарно-бактериологических и некоторых других исследованиях. Фильтрование пробы известного объема (от нескольких миллилитров до литров) позволяет сконцентрировать на поверхности фильтра содержащиеся в пробе клетки микроорганизмов. Затем их окрашивают и подсчитывают.
Для фильтрования выбирают фильтр, размер пор которого позволяет задерживать микроорганизмы, находящиеся в субстрате. Перед использованием фильтры кипятят в дистиллированной воде для удаления воздуха и остатков растворителей; воду следует 2–3 раза сменить (кипячение не должно быть слишком бурным, иначе фильтры будут скручиваться). Затем фильтр помещают на специальный держатель матовой стороной вверх и пропускают через него точно измеренный объем пробы.
Чем больше плотность клеток в исследуемом материале, тем меньше должен быть исследуемый объем, и наоборот. Клетки микроорганизмов, осевшие на фильтре, окрашивают карболовым эритрозином. Для этого фильтр помещают нижней стороной в чашку Петри на фильтровальную бумагу, увлажненную красителем, чашку закрывают крышкой и оставляют на 3–5 ч или на сутки. Для равномерного окрашивания клеток мембранный фильтр должен плотно прилегать к бумажному фильтру с эритрозином. Затем мембранный фильтр отмывают от красителя, перекладывая его в чашки Петри с фильтровальной бумагой, обильно смоченной дистиллированной водой, до тех пор, пока он не перестанет ее окрашивать. После отмывания фильтр высушивают на воздухе и готовят препарат для микроскопии. На предметное стекло наносят каплю иммерсионного масла и помещают на него окрашенный мембранный фильтр так, чтобы клетки микроорганизмов были сверху. На поверхность мембранного фильтра наносят еще каплю иммерсионного масла и покрывают фильтр покровным стеклом.
Количество клеток микроорганизмов подсчитывают с иммерсионным объективом 90× в квадратах окулярной сетки или в поле зрения микроскопа. Правила подсчета аналогичны тем, которые изложены для метода Виноградского–Брида. Количество клеток в 1 см3 исследуемого субстрата вычисляют по формуле
![]()
где М – количество клеток в 1 см3 исследуемого субстрата; а – среднее количество клеток в квадрате окулярной сетки (поле зрения); F – площадь мембранного фильтра, мм2; S – площадь квадрата окулярной сетки (поля зрения), мм2; V – объем профильтрованной жидкости, см3; 106 – коэффициент перевода мм2 в мкм2.
При выявлении и количественном учете микроорганизмов широко применяют люминесцентную микроскопию. Препараты микроорганизмов готовят непосредственно из исследуемой суспензии или ее разведения либо концентрируют клетки на специально обработанных нефлуоресцирующих фильтрах. Препараты и фильтры с микроорганизмами обрабатывают акридиновым оранжевым или другими флуоресцирующими красителями. Принципы подсчета при светлопольной и люминесцентной микроскопии одинаковы, однако окрашенные флуорохромами клетки более четко видны на темном фоне препарата, их легче отличить от небиологических объектов и произвести подсчет более точно.
Люминесцентная микроскопия дает также возможность выявить и оценить в исследуемой пробе численность отдельных групп микроорганизмов. Для этого применяют специальные флуорохромы (например, калькофлуор белый – для выявления грибов), метод иммунофлуоресценции и др.
11.2. МЕТОДЫ ВЫСЕВА НА ПИТАТЕЛЬНЫЕ СРЕДЫ
11.2.1. ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА КЛЕТОК ВЫСЕВОМ НА ПЛОТНЫЕ ПИТАТЕЛЬНЫЕ СРЕДЫ (МЕТОД КОХА)
Метод широко применяют для определения численности жизнеспособных клеток в различных естественных субстратах и в лабораторных культурах. В его основе лежит принцип Коха, согласно которому каждая колония является потомством одной клетки. Это позволяет на основании числа колоний, выросших после посева на плотную питательную среду определенного объема исследуемой суспензии, судить об исходном содержании в ней клеток микроорганизмов. Результаты количественного определения микроорганизмов, проведенного по методу Коха, часто выражают не в числе клеток, а в условных, так называемых колониеобразующих единицах – КОЕ.
Определение числа микроорганизмов этим методом включает три этапа: приготовление разведений, посев на плотную среду в чашки Петри и подсчет выросших колоний.
Приготовление разведений. Численность популяции микроорганизмов обычно велика, поэтому для получения изолированных колоний необходимо приготовить ряд последовательных разведений. Разведения готовят в стерильной водопроводной воде или в 0,85%-ном растворе NaCl (физиологическом растворе). В ходе опыта целесообразно использовать один и тот же коэффициент разведения, например 10, что уменьшает вероятность ошибки.
Для приготовления разведений стерильную водопроводную воду разливают по 9 см3 в стерильные сухие пробирки. Затем 1 см3 исследуемой суспензии стерильной пипеткой переносят в пробирку с 9 см3 стерильной воды – это первое разведение (10-1). Полученное разведение тщательно перемешивают новой стерильной пипеткой, несколько раз вбирая в пипетку и выпуская из нее полученную суспензию клеток. Затем той же пипеткой отбирают 1 см3 суспензии и переносят во вторую пробирку, получая второе разведение (10-2). Таким же образом готовят последующие разведения. Степень разведения зависит от плотности исследуемой популяции микроорганизмов (рис. 24).
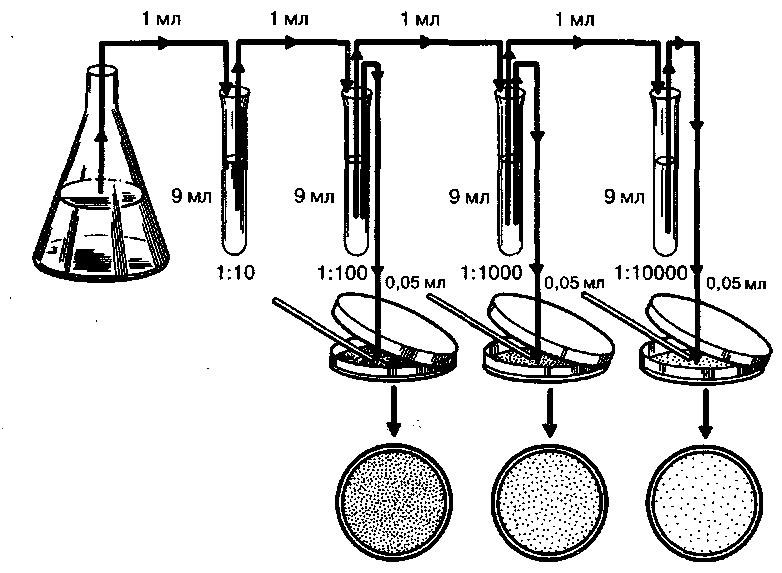
Для приготовления каждого разведения следует обязательно использовать новую пипетку. Пренебрежение этим правилом приводит к получению ошибочного результата вследствие высокой способности клеток микроорганизмов к сорбции на поверхности стекла.
Посев. Высевать суспензию можно поверхностным или глубинным способом. Перед посевом поверхностным способом разливают агаризованную питательную среду в ряд стерильных чашек Петри по 15–20 см3 в каждую. Чашки оставляют на горизонтальной поверхности, пока среда не застынет. Поверхность агаризованных сред перед посевом рекомендуется подсушить для удаления конденсационной влаги в стерильном боксе или поместив их в термостат на 2–3 суток крышками вниз.
В чашку Петри с подсушенной средой вносят точно измеренный объем (0,05 или 0,1 см3) соответствующего разведения и распределяют его стеклянным шпателем по поверхности среды. Высевы на плотную среду проводят, как правило, из трех последних разведений, причем из каждого делают 2–4 параллельных высева. Посевы можно делать одной пипеткой, но при этом начинать следует обязательно с большего разведения. Для каждого разведения используют новый стерильный шпатель. После посева чашки Петри помещают в термостат крышками вниз.
При глубинном посеве точно измеренный объем (как правило, 0,1; 0,5 или 1,0 см3) исходной суспензии или разведения вносят в расплавленную и остуженную до 45–50°С среду, тщательно перемешивают, затем немедленно выливают в чашку Петри и дают среде застыть. В случае глубинного посева пользуются средой, предварительно разлитой и проавтоклавированной в пробирках.
При больших масштабах работы среду по пробиркам не разливают, а поступают следующим образом. По 1 см3 из соответствующего разведения переносят стерильной пипеткой в 2–4 стерильные чашки Петри. Затем заливают в чашки по 15–20 см3 среды, расплавленной и остуженной до 45–50°С, и смешивают питательную среду с посевным материалом легким вращательным движением чашки по поверхности стола, после чего чашки оставляют на горизонтальной поверхности до застывания среды. Когда среда застынет, чашки Петри в перевернутом виде помещают в термостат.
Работа с дрожжами не позволяет использовать метод глубинного посева ввиду интенсивного газообразования и разрыва питательной среды. Однако, используя соответствующие ингибиторы дрожжевого роста, для определения степени инфицирования сопутствующей бактериальной микрофлорой данный метод вполне эффективен.***
Для определения количества клеток анаэробных микроорганизмов чашки Петри после посева помещают в анаэростат. Иногда для определения численности анаэробов плотную среду после засева оставляют в пробирках. Поверхность застывшей среды заливают парафином. Для лучшего учета колоний микроорганизмов среды в этом случае рекомендуется осветлять.
Подсчет выросших колоний. Колонии микроорганизмов в зависимости от скорости роста подсчитывают через 1–15 суток инкубации. Подсчет, как правило, проводят, не открывая чашек Петри. Для удобства каждую просчитанную колонию отмечают точкой на наружной стороне дна чашки. При большом количестве колоний дно чашки Петри делят на сектора, просчитывают колонии в каждом секторе и суммируют результаты. Иногда для подсчета колоний используют специальные полуавтоматические счетчики.
Лучшим разведением следует считать то, из которого при высеве в чашке Петри вырастает от 30–50 до 100–150 колоний. Если число выросших колоний меньше 10, то эти результаты для расчета количества клеток в исходном материале не используют.
Результаты параллельных высевов из одного и того же разведения суммируют и определяют среднее число колоний на одной чашке.
Количество клеток в 1 см3 исследуемого субстрата вычисляют по формуле
![]()
где М – количество клеток в 1 см3 исследуемого субстрата; a – среднее число колоний, выросших после посева из данного разведения; V – объем суспензии, взятый для посева, см3; 10n – степень разведения.
11.2.2. УПРОЩЕННЫЙ КОЛИЧЕСТВЕННЫЙ УЧЕТ ДРОЖЖЕЙ
Дрожжевые колонии в посевах учитывают следующим образом. Обратную сторону каждой чашки разделяют чернилами или тушью на большее или меньшее число частей – от четырех до шестнадцати в зависимости от густоты посева – и просматривают все колонии на каждой ограниченной площади с объективом 10× в просвечивающем микроскопе или с бинокулярной лупой в отраженном свете. Описывают все встречающиеся типы колоний в стандартных терминах. Из них готовят препараты и микроскопируют при больших увеличениях. Этот детальный просмотр колоний при первом посеве очень важен, так как при последующих пересевах некоторые признаки, например спорообразование, иногда исчезают. Рекомендуется сразу же делать фотографии или зарисовки. Колонии разных типов нумеруют и просчитывают отдельно.
Учет производят дважды. В первый срок отмечают с обратной стороны чашки все выросшие и просчитанные колонии, а затем оставляют чашки еще на несколько дней для наблюдения за возможным появлением колоний медленнорастущих дрожжей.
При необходимости количественного учета расчет численности дрожжей п в единице массы или объема исследуемого материала ведут по формуле
п = абв,
где а – среднее число колоний на одной чашке Петри; б – число капель в 1 см3 суспензии данного разведения; в – степень разбавления образца.
Отдельные изоляты (штаммы) получают путем пересева изолированных колоний в пробирки на те же среды, на которые производили первичный высев.
11.2.3. ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА КЛЕТОК С ИСПОЛЬЗОВАНИЕМ ПРИБОРА ВАКУУМНОЙ ФИЛЬТРАЦИИ
Устройство прибора и порядок работы с ним. При необходимости количественного учета микроорганизмов приоритетным является использование приборов вакуумной фильтрации отечественного и импортного производства. При некоторых различиях все они устроены по одному принципу (рис. 25, 26).
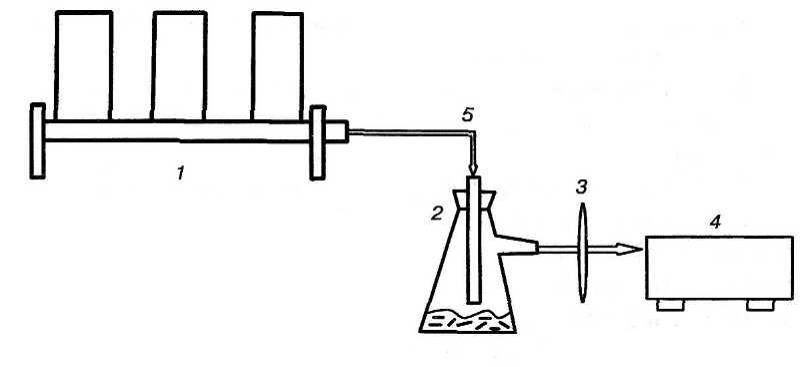
ис. 25
Принципиальная схема прибора вакуумной фильтрации:
1– фильтродержатель с воронками (1-, 3- или 6-секционный коллектор); 2 – колба Бунзена; 3 – фильтрующий блок Мидисарт; 4 – вакуумный насос; 5 – резиновый шланг.
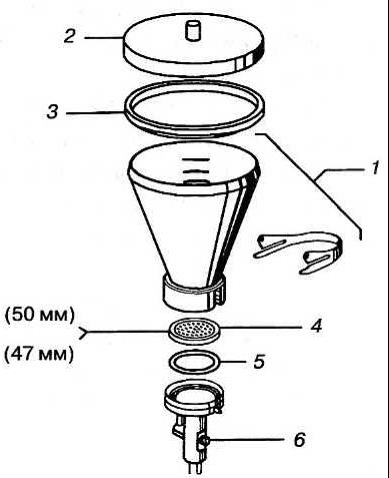
Рис. 26
Принципиальная схема сборки фильтрующего узла:
1 – воронка с запорной скобой; 2 – крышка;
3 – силиконовое кольцо; 4 – фритта из нержавеющей стали,
5 – силиконовая прокладка; 6 – кран.
Каждая фильтрационная система состоит из коллектора с тремя или шестью приваренными фильтровальными столами, укомплектованными плоским кольцом из политетрафторэтилена под фриттой из высококачественной стали, служащей в качестве опоры фильтра, и краном из высококачественной стали для регулирования вакуума в каждой отдельной фильтрационной воронке. Каждая воронка оснащена рычажным затвором для надежного крепежа на фильтровальный стол и крышкой с силиконовой уплотнительной прокладкой.
Воронка из высококачественной стали (объем 500 см3) имеет на внутренней стенке вытравленные маркировки на объемы 100, 200, 300, 400 и 500 см3. Воронка из высококачественной стали (объем 100 см3) имеет на внутренней стенке вытравленные маркировки на объемы 50 и 100 см3.
Фирма Sartorius производит приборы вакуумной фильтрации с полным набором сопутствующих материалов (фильтры, картонные подложки), предназначенных для решения задач микробиологического анализа в различных отраслях пищевой промышленности.
Безусловными их преимуществами являются: экономия времени при обычных исследованиях – можно одновременно фильтровать три или шесть проб; стабильность результатов; практичность и удобство в обращении; независимая регулировка вакуума для каждого отдельного фильтрационного узла.
Микробиологические исследования с использованием прибора вакуумной фильтрации производятся в следующем порядке:
- Очистить и продезинфицировать лабораторный стол.
- Расположить в ряд стерильные питательные среды или подготовленные питательные картонные подложки в чашках Петри. Положить рядом стерильно упакованные мембранные фильтры.
- Поставить рядом с фильтрационной установкой горелку Бунзена, стакан с небольшим количеством спирта и пинцет.
- Включить источник вакуума (электрический или водоструйный насос) и снять с коллектора воронку.
- Опалить пламенем фильтровальный стол (металлическую фритту). Открыть кран и провести пламя через фритту. Закрыть кран.
- Взять воронку и опалить ее снизу.
- Поместить металлическую воронку на фильтровальный стол и опалить ее внутреннюю часть снизу вверх, проводя пламя по спирали.
- Опалить крышку и установить ее. Теперь этот фильтровальный узел стерилен. Остальные фильтровальные узлы подготавливаются таким же образом.
- Взять стерильный мембранный фильтр плоским пинцетом, который также необходимо кратковременно обжечь; свободной рукой снять металлическую воронку с крышкой и положить мембранный фильтр по центру на фритту.
- Поместить воронку на фильтровальный стол и закрыть скобы. Таким же образом подготовить все три (или шесть) фильтрационных узлов.
- После заполнения пробами каждой воронки открыть краны и фильтровать.
- После окончания фильтрации закрыть краны. Стерильным пинцетом поочередно перенести фильтры с поверхности фритт на смоченные питательные картонные подложки или питательные среды.
- После этого чашки Петри поместить в термостат и выдержать согласно предписаниям.
Перед первым вводом в работу и после каждого употребления систему нужно прочищать и высушивать. При этом она сначала промывается горячей водой, а затем ополаскивается дистиллированной водой. При сильном загрязнении система дополнительно прочищается имеющимися в продаже лабораторными средствами для очистки (металла, стекла, пластмассы) и мягкими щетками.
При поставке краны уже смазаны консистентной смазкой (используется «высоковакуумная тяжелая консистентная смазка»). Впоследствии следует снимать, чистить, сушить, смазывать и снова монтировать краны только в случае затруднений при их открывании и закрывании. Нужно обязательно следить за тем, чтобы каждый кран был снова вставлен в то же шлифованное коническое гнездо, из которого он был вынут.
После частого употребления зажимные скобы утрачивают зажимную способность, и может быть нарушена герметичность. В этом случае необходимо подтянуть зажимную скобу легким сжиманием плоскогубцами.
Подвижные части, подверженные трению из-за открывания и закрывания, должны всегда быть слегка смазаны.
Стерильные мембранные фильтры. Такие фильтры уже давно стали стандартом в повседневном микробиологическом контроле качества.
Мембранные фильтры Sartorius соответствуют международным нормам. Фильтры поставляются готовыми к использованию и избавляют пользователя от процедуры стерилизации. Так как они индивидуально упакованы, риск контаминации даже уже открытых фильтров крайне низок, что подтверждается сертификатом GLP. Согласно требованиям GLP, каждый фильтр имеет идентификационный номер и номер серии на индивидуальной упаковке (см. табл. 11, рис. 27).

Рис. 27
Мембранный фильтр
Sartorius Тип 114
(белый фильтр с черной сеткой)
Все мембранные фильтры для микробиологии изготавливаются из нитрата целлюлозы, обеспечивающей хорошее удержание микроорганизмов, высокую скорость потока и оптимальный подсчет колоний.
Сетка, нанесенная на поверхность мембранных фильтров, с размером ячеек 3,1×3,1 мм облегчает подсчет колоний, особенно при обильном росте и большом количестве микроколоний.
Фильтры различных цветов обеспечивают контраст колоний на своей поверхности, что значительно облегчает подсчет.
Таблица 11
Характеристика стерильных мембранных фильтров Sartorius
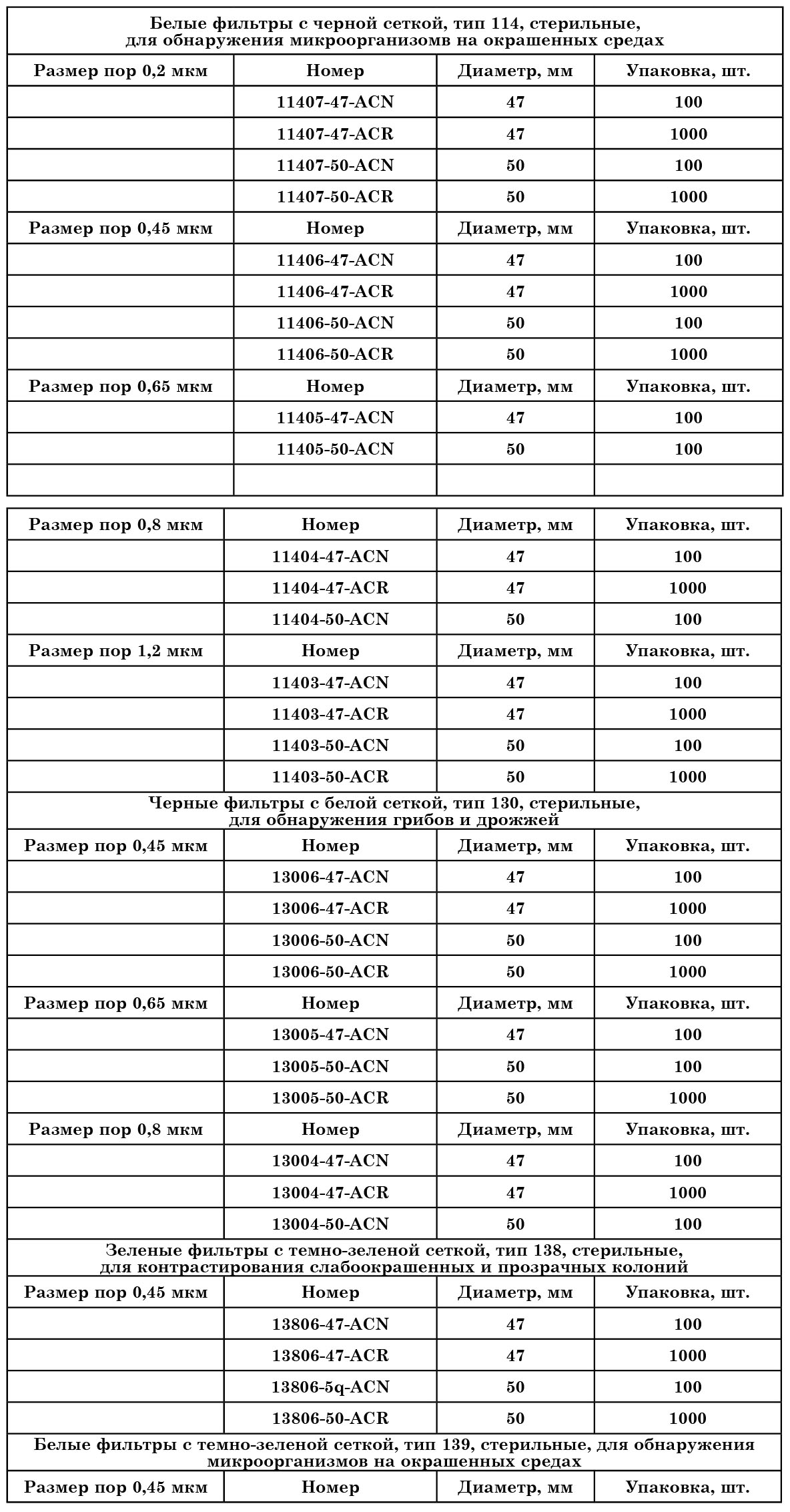
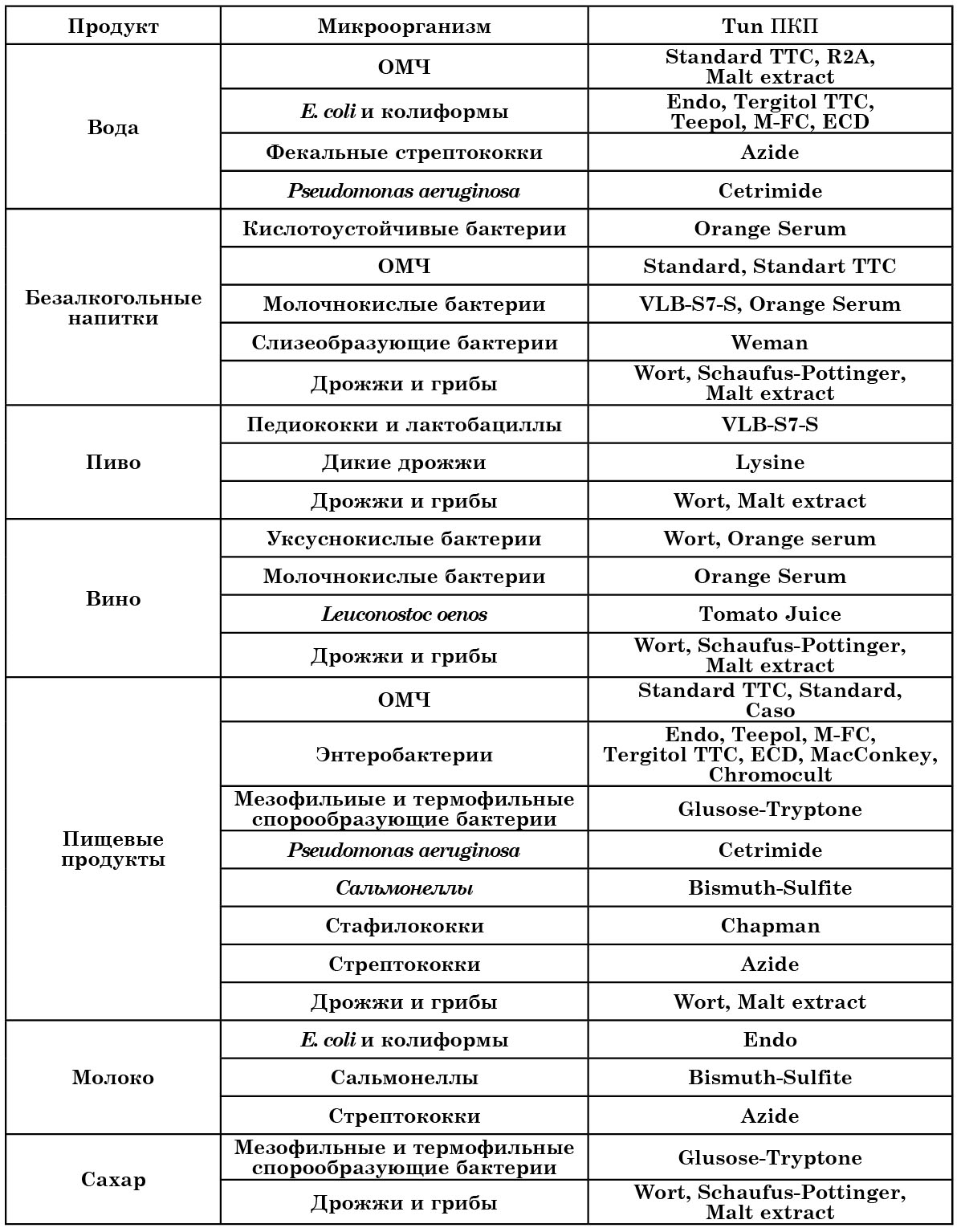
Таблица 12
Область применения питательных картонных подложек
Питательные картонные подложки. Картонные подложки Sartorius в сочетании с методом мембранной фильтрации успешно используются уже более 20 лет. Они обеспечивают простоту и легкость микробиологических исследований.
Питательная картонная подложка (ПКП) – это диск из сорбирующего материала, пропитанный селективной питательной средой, а затем высушенный в специальных условиях и стерильно упакованный в чашку Петри. Активация питательной среды проводится непосредственно перед ее использованием путем смачивания подложки стерильной дистиллированной водой. В комплекте с подложками поставляются и стерильные мембранные фильтры. Sartorius производит 26 типов ПКП (табл. 12).
11.3. ОПРЕДЕЛЕНИЕ БИОМАССЫ ВЗВЕШИВАНИЕМ
Определение биомассы состоит из трех последовательных операций: доведение массы центрифужных пробирок или фильтров до постоянного значения; отделение клеток микроорганизмов от культуральной жидкости; определение их массы. Чаще всего определяют массу сухих клеток, хотя иногда можно ограничиться определением сырой биомассы. В последнем случае первый этап отпадает; достаточно только взвесить пустую центрифужную пробирку (фильтр), но не доводить ее массу до постоянного значения. Биомассу обычно выражают в граммах или миллиграммах на литр культуральной жидкости.
Доведение массы пробирок или фильтров до постоянного значения. С этой целью фильтры, предварительно положенные в открытую чашку Петри или центрифужные пробирки (не пластиковые), помещают в сушильный шкаф и высушивают в течение 1–2 ч при температуре 80–85°С (фильтры) или 90–100°С (пробирки). Затем чашку Петри с фильтрами или центрифужные пробирки вынимают из сушильного шкафа и быстро переносят в эксикатор с безводным хлористым кальцием (CaCl2) или концентрированной серной кислотой. Эксикатор ставят около аналитических весов, на которых будет проводиться взвешивание. Через час фильтры (пробирки) взвешивают с точностью до 0,0001 г. Высушивание и взвешивание повторяют, соблюдая указанную последовательность операций, пока масса не достигнет постоянного значения, т. е. колебания в ее определениях не будут превышать десятых долей миллиграмма.
Отделение микроорганизмов от среды. Осуществляется центрифугированием или фильтрованием. В центрифужную пробирку наливают точно измеренный объем тщательно перемешанной жидкой культуры, который в зависимости от ее плотности колеблется от 5 до 20 см3. Время центрифугирования и число оборотов зависят от размеров клеток. Чем они меньше, тем больше требуется оборотов и тем продолжительнее должно быть время центрифугирования. Чаще всего центрифугируют 20–30 мин при
3–5 тыс. об/мин. После центрифугирования надосадочную жидкость осторожно сливают, осадок промывают слегка подкисленной дистиллированной водой (1 см3 концентрированной НСl на 1000 см3 воды) и снова центрифугируют при том же числе оборотов. Супернатант сливают сразу после остановки центрифуги. В противном случае часть осадка может быть потеряна.
Мицелий актиномицетов и грибов отделяют фильтрованием. Бумажный фильтр помещают в стеклянную воронку и фильтруют через него точно измеренный объем культуры – от 5 до 10 см3. Осадок на фильтре многократно промывают подкисленной дистиллированной водой.
Для отделения бактерий используют мембранные фильтры. Размеры пор мембранного фильтра должны быть меньше величины клеток, биомассу которых определяют. Мембранный фильтр помещают на пористую пластинку специального держателя, вставленного в колбу. Чтобы ускорить фильтрование, установку подключают к водоструйному насосу. Осадок несколько раз промывают подкисленной водой.
Определение биомассы. Чтобы определить массу сухих клеток, центрифужную пробирку или фильтр с осадком клеток микроорганизмов помещают в сушильный шкаф, высушивают и взвешивают. Режим высушивания и взвешивания тот же, что использовали и при определении массы пробирок или фильтров. Сухую биомассу определяют по формуле
![]()
где М – сухая биомасса г/л; А – масса фильтра (пробирки) с осадком, г; В – масса фильтра (пробирки) без осадка, г; V – объем культуральной жидкости, взятый для фильтрования (центрифугирования), см3.
Точность метода определяется полнотой отмывания клеток от компонентов среды и тщательностью взвешивания.
11.4. ОПТИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО УЧЕТА
11.4.1. ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА КЛЕТОК И БИОМАССЫ НЕФЕЛОМЕТРИЧЕСКИМ МЕТОДОМ
Питательная среда для культивирования микроорганизмов, в которой предполагается определять число клеток по светорассеянию, должна быть оптически прозрачной.
Изменение интенсивности света при прохождении через суспензию клеток измеряют с помощью нефелометра, фотоэлектроколориметра (ФЭК) или спектрофотометра, выбирая длину волны (обычно в интервале 540 – 650 нм), при которой поглощение света данной суспензией клеток минимальное. При высоких концентрациях клеток в культуральной среде происходит вторичное рассеяние света, что приводит к занижению результатов. Правила работы на указанных приборах подробно изложены в прилагаемых к ним инструкциях.
В некоторых случаях плотность клеточной суспензии выражают в показателях нефелометра. Однако чаще строят калибровочные кривые между величиной светорассеяния и числом клеток или сухой биомассой в единице объема. Для построения калибровочной кривой поступают следующим образом. Измеряют величину оптической плотности суспензии с различным содержанием клеток и в каждой из них определяют одним из применяемых методов количество клеток или биомассу. Полученную зависимость выражают графически, откладывая на оси ординат показания прибора, а на оси абсцисс – количество клеток, содержащихся в 1 см3 суспензии, или биомассу в г/л. Для каждого микроорганизма следует строить свою калибровочную кривую.
11.4.2. СТАНДАРТЫ МУТНОСТИ И ИХ ПРИМЕНЕНИЕ
В ряде случаев количество клеток в суспензии бывает достаточно определить визуально путем сравнения со стандартом мутности. Стандарты мутности представляют собой взвесь частиц стекла пирекс в дистиллированной воде. За единицу стандарта мутности условно принята мутность суспензии (в физиологическом растворе) бактерий – возбудителей тифа с концентрацией клеток 100 млн/см3. Стандарт мутности включает четыре эталона на 11, 10, 9 и 5 единиц, что соответствует содержанию 1,1·109; 1,0·109; 0,9·109 и 0,5·109 клеток в 1 см3 взвеси. Для определения количества клеток пробирку с исследуемой суспензией ставят рядом с эталоном 10 и рассматривают их в отраженном и проходящем свете на фоне белого листа бумаги, в центре которого нанесено несколько черных линий. Эталоны 9 и 11 вспомогательные, позволяющие более четко сравнить мутность исследуемой суспензии бактерий с эталоном. Стандартизация мутности суспензии бактерий (особенно часто в случае тест-организмов) имеет существенное значение при приготовлении посевного материала в серийных опытах.
При работе с дрожжами данным методом выбранный эталон требует предварительной калибровки каким-либо из описанных методов. Необходимость такой процедуры вызвана значительно большим размером дрожжевых клеток и существенными межрасовыми различиями.










