Для вычисления удельной скорости роста μ служит уравнение
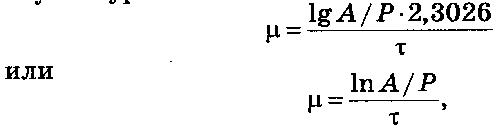
где Р – начальное содержание дрожжей (засев), кг; А – содержание дрожжей в конце цикла, кг; τ – длительность процесса, ч.
В реальном процессе на удельную скорость роста оказывает влияние множество независимых друг от друга факторов: качество питательной среды, конструкция и техническое состояние оборудования, активность засева, колебания температуры, рН среды и концентрации сахара, степень аэрации и др. Поэтому для определения реальной удельной скорости роста в конкретных условиях следует проанализировать результаты производственной деятельности методами математической статистики, с тем чтобы величины А и Р были достоверными.
13.2.1. ОПРЕДЕЛЕНИЕ ПО СКОРОСТИ СПИРТОВОГО БРОЖЕНИЯ
О скорости брожения судят по количеству углекислоты, выделившейся в единицу времени из определенного объема среды:
С6H12O6 (180 г) → 2CO2 (88 г) + 2CH3CH2OH (92 г).
Количество углекислоты устанавливают по убыли веса сосуда, снабженного затвором (рис. 35).
В колбы (или бутыли) наливают 11%-ное неохмеленное сусло. Вносят в сусло исследуемую культуру до 7–10 млн клеток в 1 см3. Количество введенных дрожжей определяют подсчетом клеток под микроскопом с помощью камеры Горяева. Колбы закрывают затворами, взвешивают и оставляют при температуре 28–30°С или температуре, соответствующей технологической. Колбы или бутыли взвешивают ежедневно до прекращения изменения массы.
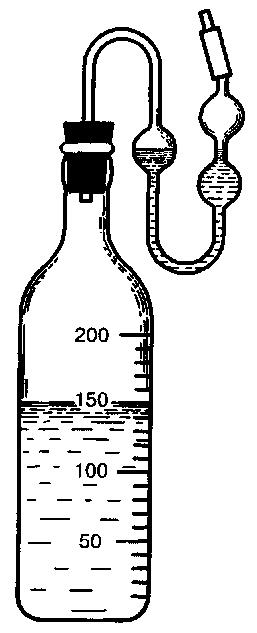
Рис. 35
Колба с сернокислым затвором для брожения
По разности начальной и конечной масс определяют бродильную активность дрожжей, выражая ее в граммах диоксида углерода, выделившегося из 100 см3 сусла.
Рассчитывают, сколько граммов СO2 выделилось из 1000 см3 среды в 1 ч за каждый интервал времени между взвешиваниями сосуда. Для регистрации результатов можно использовать таблицу 19.
Таблица 19
Динамика выделения СО2 при брожении
Более информативным и технологически верным будет пересчет граммов СO2, выделившихся из 1000 см3 среды в 1 ч на 1 млн клеток засевных дрожжей.***
13.2.2. ОПРЕДЕЛЕНИЕ ПО КОЛИЧЕСТВУ ЭТАНОЛА
Количество этанола, образовавшегося при брожении, определяют оксидиметрическим методом, основанным на окислении этилового спирта до уксусной кислоты и воды смесью бихромата калия с серной кислотой:
3СН3СН2ОН + 2K2Cr2O7 + 8H2SO4 =
= 3СН3СООН + 2Cr(SO4)2 + K2SO4 + 11H2O.
По окончании окисления спирта избыток бихромата оттитровывают раствором соли Мора:
К2Сг2O7 + 6FeSO4(NH4)2SO4 + 7H2SO4 =
= Cr2(SO4)3 + 3Fe2(SO4)2 + 6(NH4)2SO4 + 7H2O + K2SO4.
По количеству бихромата, израсходованного на окисление, вычисляют концентрацию спирта. Наиболее точные результаты метод дает при содержании спирта в жидкости в пределах 1–2%. Поэтому при более высоких концентрациях спирта разбавляют культуральную жидкость, а при меньших – растворы соли Мора и бихромата.
В мерную колбу на 100 см3 помещают 20 см3 культуральной жидкости, освобожденной от клеток декантацией, фильтрованием или центрифугированием. Содержимое колбы доводят до метки дистиллированной водой, перемешивают и берут 10 см3 в круглодонную колбу на 50–75 см3. В трехшариковый приемник наливают 25 см3 раствора бихромата и 10 см3 концентрированной H2SO4. Колбу плотно закрывают резиновой пробкой с отводной трубкой, суженный конец которой должен доходить почти до дна приемника (см. рис. 36). Затем в течение 10–15 мин отгоняют две трети содержимого колбы. Раствор бихромата за это время меняет окраску от оранжевой до грязно-бурой. После отгонки во избежание обратного перебрасывания жидкости из приемника убирают приемник и только потом отставляют горелку.
Содержимое приемника переносят в мерную колбу на 100 см3. Дистиллированной водой споласкивают приемник и отводную трубку, и промывные воды выливают в ту же мерную колбу. После этого раствор в колбе доводят до метки дистиллированной водой, перемешивают, отбирают из него 20 см3 в коническую колбу на 250 см3, добавляют 20 см3 дистиллированной воды и титруют солью Мора.
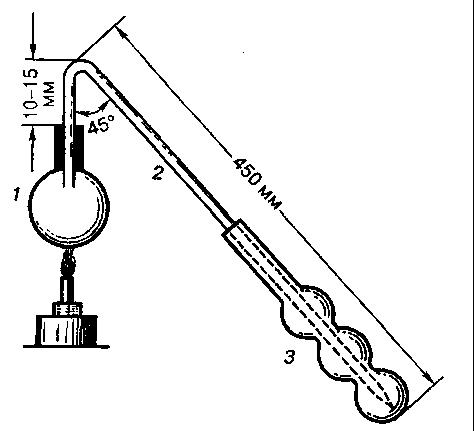
Рис. 36
Прибор Мартена для определения спирта:
1 – круглодонная колба;
2 – отводная трубка;
3 – приемник
Параллельно ведут контрольное титрование, чтобы определить, сколько соли Мора идет на титрование 5 см3 раствора бихромата. Для этого в коническую колбу помещают 5 см3 раствора бихромата, 2 см3 концентрированной серной кислоты, 30–40 см3 дистиллированной воды и титруют солью Мора. Так как соль Мора нестойкое соединение, контрольное титрование обязательно делают при каждом определении. Конец титрования устанавливают капельной пробой с раствором феррицианида. Для этого на чистую белую фарфоровую или керамическую пластинку стеклянной палочкой наносят каплю титруемой жидкости и рядом из капельницы – каплю раствора феррицианида. Интенсивное синее окрашивание, получаемое при слиянии капель, указывает на конец реакции. Опытный раствор и контроль титруют по два раза. Первое титрование служит для получения ориентировочных результатов, поэтому реакцию титруемой жидкости с раствором феррицианида проводят после добавления каждого миллилитра раствора соли Мора. При втором титровании из бюретки сначала сливают без пробы на индикатор большую часть того количества раствора соли Мора, которое было определено первым титрованием, а затем делают качественную реакцию каждый раз после добавления 0,1 см3 раствора соли Мора.
Количество этанола (г/10 см3) в культуральной жидкости рассчитывают по формуле
![]()
где а – см3 раствора соли Мора, пошедшие на титрование контроля; б – см3 раствора соли Мора, пошедшие на титрование опыта; 25 – см3 К2Сг2O7; 5 – разведение культуральной жидкости (20 см3 до 100 см3); 0,01 – грамм этанола соответствует 1 см3 К2Сг2O7.
Метод основан на том, что состав сусла не всегда одинаков, и определение бродильной энергии дрожжей целесообразнее проверять на растворе какого-либо сахара. Прибор, применяемый для этой цели, состоит из колбочки емкостью 50 см3, присоединенной резиновой трубки, бюретки и уравнительного сосуда. Бюретку и уравнительный сосуд заполняют 20%-ным раствором NaCl, подкисленным ортофосфорной кислотой до рН 1,0. Этот раствор почти не поглощает СO2. В колбочку помещают трехсуточную культуру дрожжей (выращенных на сусло-агаре), промытых и отпрессованных между листками фильтровальной бумаги. В навеске должно содержаться около 0,15 г сухих веществ (определенный вес, например 0,7 г с влажностью около 75%). Затем в колбочку наливают 30 см3 10%-ного раствора сахара (глюкозы), содержащего 0,2% КН2РO4. Колбочку закрывают пробкой и из бюретки вытесняют воздух, пользуясь уравнительным сосудом. Уровень раствора в бюретке устанавливают на ноль. После этого поворотом трехходового крана соединяют емкость колбочки с бюреткой и начинают процесс брожения, который ведут при температуре 20°С в течение 3 ч. Через каждый час уровень жидкости в бюретке отмечают и устанавливают на ноль.
По объему образовавшегося СO2 за 3 ч (по сумме трех объемов) судят о бродильной способности дрожжей. Хорошо бродящие дрожжи за 3 ч образуют около 30 см3 СO2.
13.2.4. МАНОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ БРОДИЛЬНОЙ АКТИВНОСТИ***
Для определения бродильной активности дрожжей используется прибор, состоящий из колбы (объем 300–500 см3), газоотводной трубки с краном и чувствительного манометра (медицинский, для определения артериального давления) (рис. 37).
Перед началом работы измеряют объем используемой колбы до нижнего края тщательно притертой пробки и объем газоотводной трубки. Для этого заполняют колбу и трубку водой, затем мерным цилиндром измеряют объем вместившейся жидкости.
Воспользовавшись уравнением Менделеева – Клапейрона, определяют необходимую величину давления в свободном объеме используемой колбы. Порядок расчета величины давления описан в пп. 12.4.2.
В колбу вносят 0,7 г отпрессованных на воронке дрожжей, 30 см3 солодового сусла
(8–10% СВ) или 10%-ного раствора сахара и взбалтывают до получения однородной суспензии. Колбу тщательно закрывают и через газоотводную трубку соединяют с манометром. Для уравнивания давления в колбе с атмосферным давлением извлекают подвижную часть краника и сразу помещают на место, тщательно притерев и совместив отверстия. Подготовленный таким образом прибор переносят в термостат при температуре, соответствующей технологической, и регистрируют время, за которое стрелка манометра достигнет необходимой отметки, соответствующей определяемому количеству выделенного диоксида углерода.
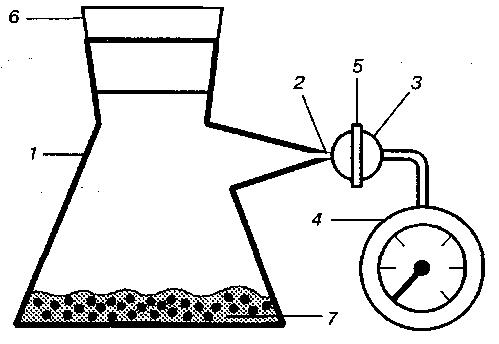
Рис. 37
Прибор для брожения:
1 – колба; 2 – газоотводная трубка; 3 – краник; 4 – манометр;
5 – подвижная часть краника; 6– пробка; 7 – дрожжевая суспензия.
П р и м е р. Для оценки бродильной активности пивных и винных дрожжей регистрируется 28–30 см3 СO2. Такое количество газа хорошими дрожжами выделяется не более чем за 3 ч.
Конечная степень сбраживания является не только важным показателем технологической оценки углеводного состава сусла, но и характеризует физиологические возможности исследуемых дрожжей, имеющие решающее значение в оптимизации технологического процесса.
Метод основан на экспериментальном сбраживании дрожжами субстрата с последующим установлением количества сброженных сахаров.
В зависимости от поставленной задачи и особенностей исследуемой расы дрожжей начальная концентрация СВ в субстрате может колебаться от 15 до 20 и более %.
Для того чтобы исключить влияние состава сусла на результаты эксперимента, можно использовать среду постоянного состава.
Глюкоза
(сахароза, мальтоза)............................... 150–200 г
Дрожжевой автолизат................................. 5,0 см3
Биотин....................................................... 0,02 см3
Вода................................................. до 1000,0 см3
Приготовленный субстрат разлить в бутылки по 200 см3 и туда же внести по 0,5 г отпрессованных на воронке исследуемых дрожжей. Тщательно перемешать до однородной суспензии и инкубировать. На каждую культуру готовить по 10 бутылок и определять степень сбраживания с интервалом 6–12–24 и более часа.
Температурный режим инкубации может быть оптимальным для дрожжей — 28–30°С или же устанавливаться в зависимости от технологических особенностей.
Измерение вести до трех одинаковых результатов, первый из которых считать конечной степенью сбраживания. Перед измерением плотности субстрат фильтровать через бумажный фильтр, возвращая в воронку первые порции.
Конечную степень сбраживания, показывающую количество в сусле сброженных веществ, считают в процентах к их массе в исходном субстрате по формуле
![]()
где тсв – массовая доля сухих веществ в начальном субстрате, %; mсв1 – видимая массовая доля сухих веществ в субстрате на момент измерения, %. Регистрируется:
- конечная степень сбраживания;
- скорость сбраживания;
- динамика сбраживания, выраженная графически.
Подъемная сила – основной показатель качества хлебопекарных дрожжей; чем быстрее дрожжи поднимают тесто, тем выше их качество. Хорошие дрожжи поднимают тесто за 60–65 мин. В соответствии с требованиями стандарта подъемная сила товарных дрожжей не должна превышать 75 мин.
Следует помнить, что подъемная сила дрожжей может несколько изменяться в зависимости от влажности и качества муки.
13.4.1. ПОДЪЕМНАЯ СИЛА ПРЕССОВАННЫХ ДРОЖЖЕЙ
Стандартный метод. 280 г пшеничной муки 85%-ного помола помещают в термостат при температуре 35°С не менее чем на 2 ч. Затем подогревают до 35°С 160 см3 2,5%-ного раствора поваренной соли, 5 г анализируемых прессованных дрожжей, отвешенных на технических весах с точностью до 0,01 г, смешивают в фарфоровой чашке с 15–20 см3 подготовленного, как указано выше, раствора поваренной соли до исчезновения комков. Разведенные дрожжи быстро вливают в дежу лабораторной тестомесильной машины с частотой вращения 135 об/мин. Оставшимся раствором соли ополаскивают чашку из-под дрожжей и тоже выливают в дежу. Затем насыпают 280 г согретой муки и включают тестомесильную машину.
Через 5 мин тестомесильную машину останавливают, вынимают тесто, придают ему форму батона и кладут в металлическую форму, также предварительно нагретую в термостате при 35°С и смазанную растительным маслом.
При отсутствии месильной машины тесто замешивают вручную, соблюдая указанный выше режим его приготовления.
Форма должна иметь в продольном и поперечном разрезах трапецию следующих внутренних размеров (в см): верхние основания 14,3×9,2, нижние – 12,6×8,5, высота – 8,5. На длинные борта ее навешивают поперечную металлическую перекладину, входящую в форму на 1,5 см (рис. 38).
Пробу ставят в термостат с температурой 35°С и фиксируют время. Когда тесто коснется нижнего края перекладины, вновь отмечают время.
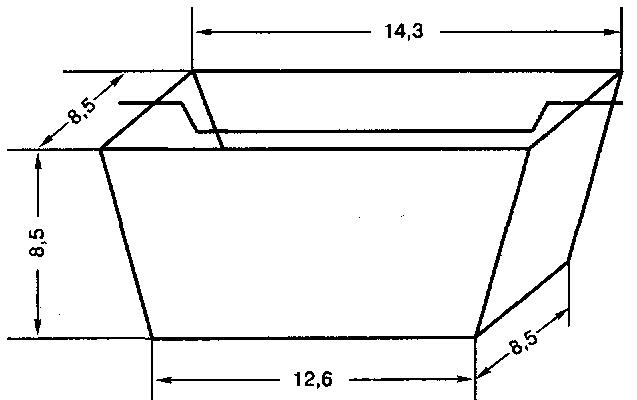
Рис. 38
Форма для определения подъемной силы дрожжей
Скоростью подъема теста, или подъемной силой, считают продолжительность (в мин) нахождения теста в форме с момента внесения его до соприкосновения с нижним краем перекладины.
Хорошие дрожжи показывают подъемную силу не более 60–65 мин.
«По шарику». Навеску дрожжей массой 0,31 г перемешать в ступке с 4,8 см3 подогретой до 35°С воды. Добавить 7,0 г муки II сорта и быстро замешать, придав замесу форму шарика, не прилипающего к рукам. Шарик погрузить в стакан с водой температурой 32°С. Стакан поместить в термостат при 32°С.
Регистрировать время от погружения до всплытия шарика.
Хорошие дрожжи показывают подъемную силу не более 25 мин.
Время, затраченное на всплывание шарика (мин), умножают на коэффициент 3,5 и получают величину подъемной силы, определяемую стандартным способом.
13.4.2. ПОДЪЕМНАЯ СИЛА СУХИХ ДРОЖЖЕЙ
К навеске сушеных дрожжей (2,5 г), взятой на технических весах, добавляют 30 см3 водопроводной воды, нагретой до 35°С. Смесь помещают в термостат при температуре 35°С на 30 мин. К размокшим дрожжам добавляют 15 г пшеничной муки II сорта, тщательно размешивают и вновь ставят в термостат на 2 ч. Одновременно в термостат помещают 265 г муки того же сорта, 130 см3 воды, в которой растворено 4 г поваренной соли, и стандартную форму (см. рис. 38), смазанную растительным маслом. Через 2 ч смесь дрожжей, воды и муки переводят в дежу лабораторной тестомесильной машины (или большую фарфоровую чашку), смывая остатки смеси 130 см3 солевого раствора, после чего засыпают 265 г согретой муки. Тесто замешивают в течение 5 мин с момента внесения дрожжей, затем переносят его в форму и далее поступают так же, как при определении подъемной силы прессованных дрожжей.
13.5. СУЛЬФИТОСТОЙКОСТЬ ВИННЫХ ДРОЖЖЕЙ
Способ 1. Для сравнительного изучения сульфитостойкости различных культур дрожжей их нужно подвергнуть действию одинаковой дозы свободной SO2. Сульфитостойкие расы можно отбирать по скорости забраживания виноградного сусла, содержащего 100 мг/дм3 свободной SO2 в момент внесения в сусло разводок изучаемых культур.
Вначале проводят пробную сульфитацию сусла разными дозами SO2 и выбирают такую, при которой через час после внесения SO2 в сусло в нем будет содержаться около 100 мг/дм3 свободной сернистой кислоты. Сразу после сульфитации содержание ее быстро уменьшается, так как она вступает в соединение с составными частями сусла (са-харами, альдегидами и др.), а спустя 1–2 ч ее количество уже заметно не меняется. Затем сульфитируют сусло выбранной дозой SO2 в склянке вместимостью 2000 см3 с нижним тубусом, склянку закрывают, сусло перемешивают и оставляют на час.
За это время в стерильные небольшого объема склянки, размеченные до стерилизации по 20 см3, вносят по 0,2 см3 двухсуточных разводок исследуемых рас дрожжей. Каждую культуру вносят в три склянки, т. е. опыты ставят в трех повторениях.
Через час после сульфитации сусло из 2-литровой склянки разливают через нижний тубус по 20 см3 в склянки быстро, но осторожно, чтобы оно не разбрызгивалось. Для предотвращения улетучивания SO2 склянки закрывают резиновыми пробками, обработанными спиртом, и затем ставят в термостат при температуре 27°С. При такой постановке опыта все культуры дрожжей подвергаются действию одинаковой дозы свободной SO2. Ежедневно в течение 10 дней опытные склянки просматривают и отбирают сульфитостойкие расы дрожжей по скорости размножения и забраживания сусла.
Способ 2. Быстрее и проще можно определять сульфитостойкость по скорости размножения штаммов дрожжей на сульфитированном виноградном сусло-агаре в чашках Петри. Сусло перед розливом в чашки Петри смешивают с равным количеством 3%-ного водного агара. В связи с невозможностью определять содержание сернистой кислоты в сусло-агаре для подбора дозы сульфитации виноградное сусло в нескольких контрольных порциях смешивают с таким же количеством водопроводной воды (вместо 3%-ного водного агара). Разбавленное сусло в склянках сульфитируют несколькими дозами крепкого водного раствора сернистой кислоты для того, чтобы можно было выбрать дозу сульфитации, при которой через час после внесения SO2 в сусле, а также в сусло-агаре будет содержаться около 100 мг/дм3 свободной сернистой кислоты. Содержание свободной сернистой кислоты определяют йодометрическим методом.
Штаммы исследуемых дрожжей предварительно выращивают в течение 2 суток в виноградном сусле при температуре 27°С, а затем уколом иглы наносят на поверхность сульфитированного сусло-агара в количестве 25 штаммов на чашку. Кончик иглы для этого погружают в разводки исследуемых культур примерно на 1 см. Чашки Петри с посевами помещают в термостат и выдерживают при температуре 27°С. Ежедневно в течение недели просматривают чашки Петри и отбирают сульфитостойкие штаммы, колонии которых вырастают раньше.
Первичный отбор проводится при содержании свободной сернистой кислоты 100 мг/дм3, а затем наиболее сульфитостойкие штаммы отбирают при содержании ее 150 мг/дм3.
Для получения более объективной информации следует использовать микроскопические методы оценки состояния исследуемых культур дрожжей.
13.6. ТЕХНОЛОГИЧЕСКАЯ УСТОЙЧИВОСТЬ КУЛЬТУРЫ. АВТОЛИЗНОЕ ЧИСЛО***
Для оценки степени устойчивости дрожжевой культуры к неблагоприятным факторам питательной среды может использоваться тест для определения технологической стойкости дрожжей – автолизное число.
Тест основан на определении количественной разницы в среде аминно-аммонийного азота между двумя измерениями с учетом прироста клеточной массы. Ввиду того, что стадии разбраживания и активного брожения (лаг-фаза Þ фаза логарифмического роста) сопровождаются активным приростом пока еще здоровой клеточной массы, а значит, активным потреблением доступного азота, измерения следует начинать по завершении стадии активного брожения – при переходе культуры в стационарную фазу Þ фазу затухания Þ гибели. Интервал между измерениями может быть выбран произвольно в течение всего периода брожения.
Суть предлагаемого теста видна из формулы
![]()
где А – автолизное число; N1 – количество усвояемого азота начальное; N2 – количество усвояемого азота конечное; K1 – концентрация дрожжей начальная; К2 – концентрация дрожжей конечная.
Таким образом, автолизное число выражает увеличение/уменьшение количества аминно-аммонийного азота в среде на 10 млн/см3 клеток дрожжей между двумя измерениями.
Полученные результаты могут регистрироваться на графике, отображающем время брожения и величину автолизного числа.
Избыточное увеличение аминно-аммонийного азота, или высокий показатель автолизного числа, может свидетельствовать о высокой интенсивности автолизных процессов и, как следствие, слабости или дефектности очередной генерации или культуры вообще.
Вместе с тем, чем больше автолизное число, тем больше биомасса подвержена воздействию неблагоприятных факторов среды с точки зрения ее физико-химических параметров.
Тест и более информативен, и более объективен, нежели простой подсчет процентного соотношения живых и мертвых клеток, который на сегодняшний день в производственных лабораториях является единственным критерием оценки жизнеспособности культуры. Данный анализ позволяет не только констатировать факт гибели клетки, но и оценить степень ее деструктивных изменений, учесть весь массив факторов, воздействующих на дрожжевую клеточную массу в процессе брожения, с учетом технологических особенностей конкретного предприятия.
Изменяя те или иные параметры брожения по показателю автолизного числа, можно определить жизнеспособность клеточной популяции в конкретных физико-химических условиях среды.
Усвояемый азот в среде определяется формольным титрованием. Сущность метода заключается в том, что формалин реагирует с аминогруппами большинства аминокислот и вытесняет серную кислоту из аммонийных соединений. Образующиеся метиленаминогруппы и серная кислота оттитровываются щелочью.
Способ 1. 10 см3 среды через бумажный фильтр отфильтровывают от дробины и дрожжей, разбавляют дистиллированной водой до 100 см3 и титруют 0,1 Н раствором NaOH с фенолфталеином до слаборозового окрашивания. Затем туда же вносят 5,0 см3 нейтрального формалина и вторично титруют тем же раствором NaOH до слаборозового окрашивания.
Количество миллилитров 0,1 Н NаОН, пошедшее на вторичное титрование, называют формольным числом исследуемой жидкости, оно является величиной относительной.
Чтобы выразить формольное число в абсолютных величинах растворенного в среде аминного и аммонийного азота, нужно формольное число умножить на коэффициент 0,0014, т. е. 1 см3 1 Н раствора NаОН соответствует 0,014 г азота в 1000 см3 среды.
Способ 2. В стакане взвешивают 25±0,01 г питательной среды, и навеску теплой дистиллированной водой, освобожденной кипячением от СO2, переводят в мерную колбу на 100 см3.
Раствор охлаждают до 20°С, доводят водой до метки и перемешивают.
В химический стакан отбирают пипеткой 20 см3 полученного раствора и титруют 0,1 Н раствором щелочи до рН = 7,0. Затем сюда же приливают 5 см3 формольной смеси и продолжают титрование до рН = 9,1.
Для контрольного титрования в химический стакан отмеривают 20 см3 дистиллированной воды и 5 см3 формольной смеси и также титруют до рН = 9,1.
Содержание аминно-аммонийного азота рассчитывают по формуле
N = 0,0014 · (а - б) ·100 : Н,
где N – усвояемый азот (%); a – объем 0,1 Н щелочи, пошедшей на титрование 20 см3 раствора питательной среды (см3); б – то же, на титрование контрольной пробы (см3);
Н – навеска питательной среды в 20 см3 раствора (г).
Например, N = 0,0014 · (11,2 - 0,2) · 100 : 5 = 0,31%
Формольная смесь.
Формалин, х. ч...................................... 50,0 см3
Фенолфталеин, 1%................................ 1,0 см3
Оттитровать 0,1 Н NаОН до слаборозового окрашивания.
Пригодна в течение 2–3 дней.










