В процессе получения, обработки и хранения молоко может подвергаться воздействию различных световых излучений. Кроме охлаждения и термической обработки, молоко может быть подвергнуто как специальному, так и случайному замораживанию. И наконец, при производстве молочных продуктов молоко подвергается сепарированию, которое, как сильный механический фактор, может повлиять на перераспределение ферментов между водной, жировой и белковой фазами молока.
Действие света. В зависимости от вида световое излучение в различной степени воздействует на составные компоненты молока и в том числе на ферменты. Излучение в ближней инфракрасной области спектра (1000 нм) вызывает только колебания молекул, а в видимой части спектра (800...400 нм) – возбуждает молекулы более сильно.
Средневолновое ультрафиолетовое (УФ) излучение (315...280 нм) может вызвать ионизацию молекул. Энергия поглощенного света повышает кинетическую энергию молекул ферментов и дает энергию активации для химических превращений.
Под действием УФ-излучения происходит разрушение некоторых витаминов, производные которых являются коферментами многих ферментов. Особой активностью отличаются волны длиной около 440 нм от люминесцентных ламп. УФ-излучение с длиной волны около 300 нм разрывает сульфгидрильные группы в сывороточных белках, а следовательно, и в ферментах.
В литературе имеются некоторые данные о влиянии световых излучений на отдельные ферменты молока., Так, активности ксантиноксидазы, каталазы и пероксид-дисмутазы снижаются под действием УФ-излучения (по Hicks Е. L., 1980). Активность липазы снижается на 40...80 % в зависимости от длительности воздействия и расстояния источника УФ-излучения. Чувствительна к воздействию УФ-излучения и липопротеинлипаза (по Chilliard Y., 1982). В то же время кислая фосфатаза является довольно устойчивой к воздействию такого излучения.
Воздействие белого света от люминесцентной лампы мощностью 20 вт в течение 3 ч на расстоянии 20 см повышало активность протеаз сырого сборного обезжиренного молока, в результате чего увеличение степени протеолиза составило 33 % (Igarashi Y., 1990).
Считают, что многие другие ферменты молока как нативного, так и микробного происхождения также неустойчивы к воздействию активных коротковолновых и УФ-излучений.
Замораживание. При замораживании в молоке происходят более глубокие изменения, чем при охлаждении. Сила воздействия замораживания зависит от скорости этого процесса, температуры и продолжительности хранения молока. При замораживании воды образуются кристаллы льда различной формы, имеющие острые вершины и кромки, вследствие чего они могут оказывать отрицательные механические воздействия на составные компоненты молока. В результате частичных деформаций ОШЖ и дезагрегации мицелл казеина, с которыми связаны многие окислительно-восстановительные и гидролитические ферменты, ферментативная активность молока в той или иной степени изменяется. Так, при замораживании сырого коровьего молока общая активность лактатдегидрогеназы увеличивалась в 1,5 раза, а в молоке овец, коз и кобыл – в 4,0, 1,6 и 2,0 раза соответственно (Dvorák J., Mašková V.).
Вследствие изменения состояния оболочек шариков жира (ОШЖ) при замораживании молока может произойти активирование ксантиноксидазы, что подтверждает данные по заметному повышению ее активности при хранении такого молока (Zikakis J. Р., Wooters S. С., 1980). Отмечается довольно устойчивое повышение активности этого фермента в течение 72 ч хранения молока при –20 °С (превышение начальной активности почти в 15 раз). Это увеличение активности фермента превышало почти в 4 раза увеличение его активности при хранении молока при 4 °С в течение такого же периода времени.
Установлено повышение активности и сульфгидрилоксидазы в условиях хранения молока при -4, -12 и -20 °С, что связывают с возможным расщеплением молекулы фермента на субъединицы (Kiermeier F., Ranfft К.) (табл. 62).
Медленное замораживание молока при –5...–12°С может вызвать дестабилизацию жировой дисперсии молока. Шарики жира постепенно отвердевают, приобретая угловатую форму, изменяется состояние ОШЖ, происходит денатурация белков ОШЖ, а следовательно, и десорбция ряда ферментов, находящихся в ОШЖ. Кроме того, вследствие дестабилизации ОШЖ происходит частичное выделение свободного жира, что вследствие частичного высвобождения липаз из мицелл казеина при их дезагрегации может повыситься, а следовательно, и ускорится возможность возникновения липолиза молока. Вот почему использование на производстве размороженного молока может привести к развитию липолиза в молоке и молочных продуктах, а следовательно, к появлению нежелательного липолизированного вкуса.
Активность такого важного фермента как лизоцим при хранении замороженного молока (–4 °С) в течение 2 ч снижалась почти на 5%, а в течение 48 ч – на 71 % (Shahani К. М., Chandan R., Kelly Р.).
Медленное замораживание молока вызывает большие изменения активности ферментов, связанных с ОШЖ, чем быстрое замораживание. Высокая скорость замораживания молока при около –25 °С способствует образованию микроскопической ледовой структуры, что снижает воздействие ее на белковую и жировую дисперсии, а следовательно, и повышение активности ферментов, связанных с компонентами этих фаз (по Горбатовой К. К., 2004).
Таблица 62
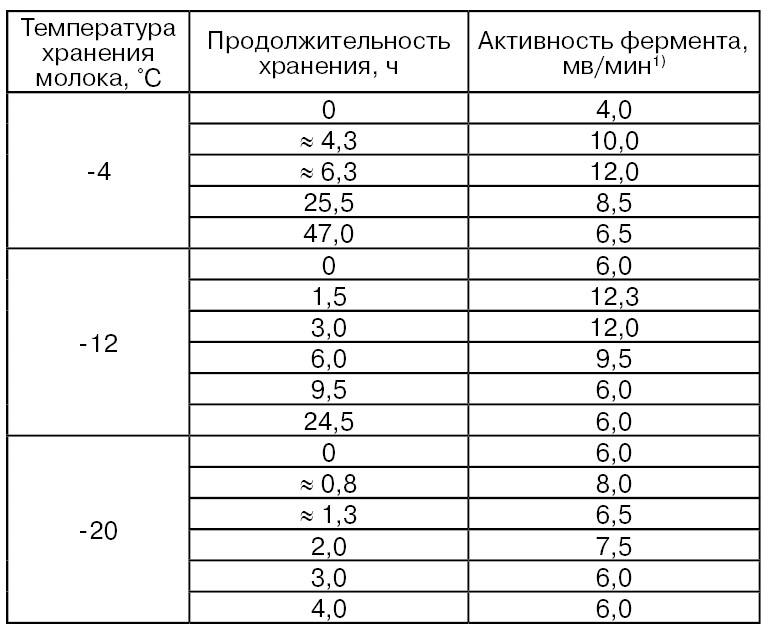
1) При 37°С и pH 7,0.
Сепарирование. При сепарировании составные части молока подвергаются воздействию радиальных сил. В первую очередь, эти силы изменяют характер распределения шариков жира, который, в свою очередь, зависит от их радиуса. При воздействии радиальных сил на ОШЖ может иметь место частичная десорбция некоторых ферментов, связанных с ними. Механическая энергия сепарирования часто превышает энергию гидрофобных связей в ОШЖ, что приводит к их частичному разрушению, а следовательно, к повышению содержания свободного жира в сливках. Это, в свою очередь, может обусловить в дальнейшем усиление липолиза, ухудшение органолептических показателей сливок, поскольку свободный жир является идеальным субстратом для липаз молока.
Таким образом, при сепарировании сырого молока в результате механического воздействия на компоненты молока, главным образом на шарики жира и мицеллы казеина, происходит количественное перераспределение некоторых ферментов между его жировой, белковой и водной фазами (табл. 63). По данным различных исследователей, в обезжиренное молоко переходит большое количество гидрогеназ, и в частности пируватдегидрогеназы, липазы, щелочной и кислой фосфатаз, лизоцима, амилаз, N-ацетил-β-глюкозаминидазы и протеаз, т. е. в основном тех ферментов, которые в достаточно большом количестве связаны с белковыми компонентами молока или находятся в свободном состоянии, или попадают в обезжиренное молоко с ОШЖ. При
сепарировании молока некоторая часть ферментов попадает в Сепараторный шлам, например диаминоксидаза, каталаза и лактопероксидаза, щелочная и кислая фосфатазы, амилазы и др., т. е. безвозвратно теряется.
Таблица 63
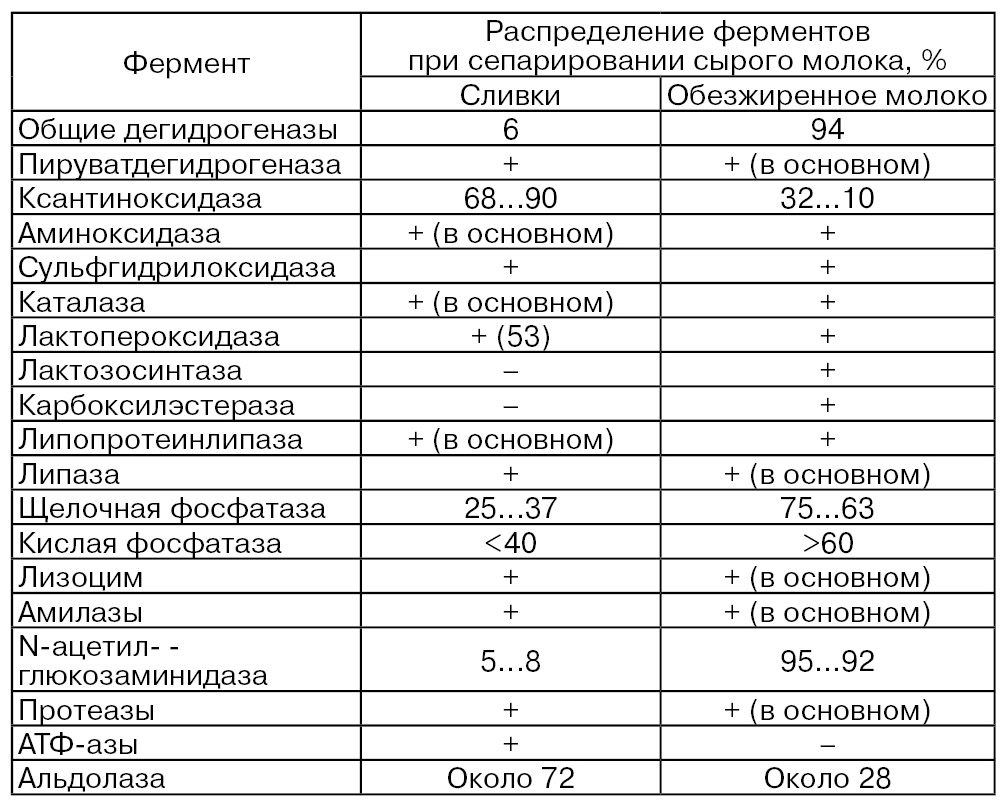
Обозначения: «+» – наличие фермента в продукте; «–» – отсутствие фермента в продукте.
Высушивание. Одним из факторов, способствующим снижению активности окислительно-восстановительных ферментов молока является сушка. Так, если общую дегидрогеназную активность свежего сырого молока принять за 100%, то после пастеризации (72...76°С с выдержкой 15...20 с) она снижается почти на 50%, а при распылительной сушке – на 70%. Исследования показывают, что сублимационная сушка молока значительно снижает активность важнейшего фермента молока – каталазы, а именно при температурах –10, –20, –30 и – 40 °С активность этого фермента снижалась на ≈ 72, 78, 79 и 81 % соответственно. При этом использование углеводных добавок – сахарозы, глюкозы и лактозы в концентрации 0,03 М является почти 100%-ной стабилизацией фермента против его инактивации (Ito О., Akuzawa R., 1983).
Ультразвуковая обработка. С целью нахождения альтернативы тепловой обработке, проведены исследования по обработке молока ультразвуком и влияния его на ферменты. Считают, что это воздействие очень комплексно, встречается и активирование и инактивация, что зависит от условий и интенсивности обработки, оборудования, а также от вида фермента и среды. Исследования показывают увеличение эффективности УЗ-обработки при тепловой обработке и гомогенизации, например, на липоксигеназу, лактопероксидазу, лакказу, липазу и протеазу.
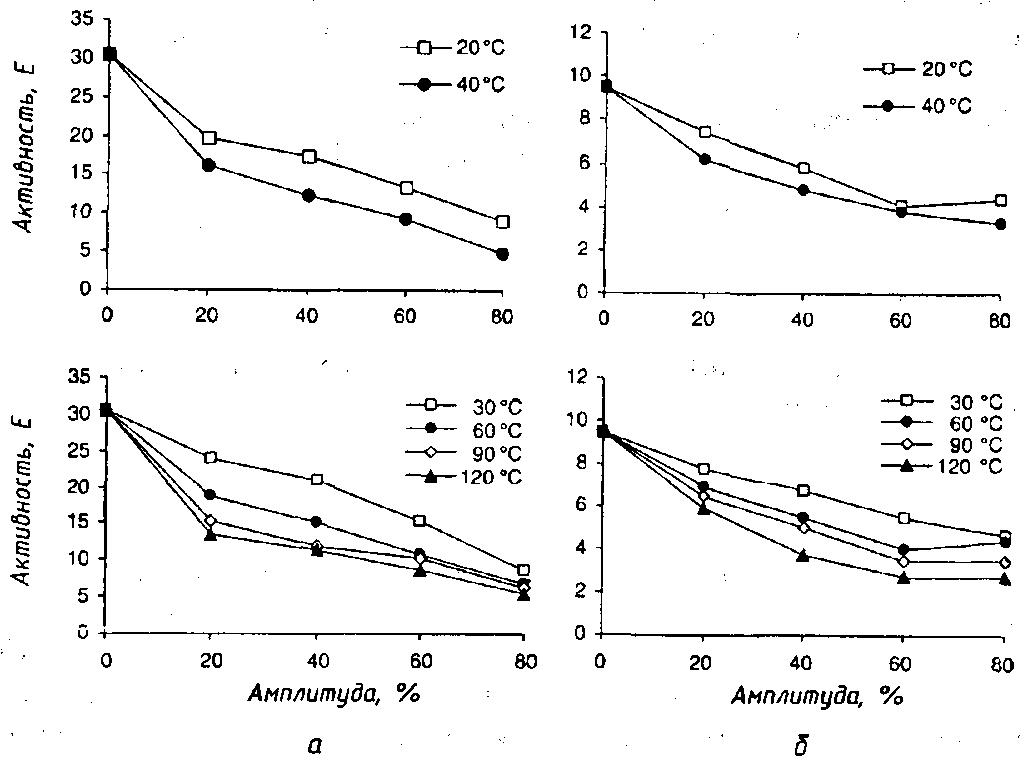
Рис.48. Влияние УЗ-обработки на активность лактопероксидазы и щелочной фосфатазы сырого коровьего молока (Martin D., Kiesner С. et al., 1998):
а – лактопероксидаза; б – щелочная фосфатаза
Считают, что механизм УЗ-влияния на ферменты молока состоит в кавитации, т. е. образовании сильного коллапса, приводящее к микромеханическому шоку, в нагревании (специфическая абсорбция акустической энергии), в силовом перемешивании и стрессовой скорости, турбулентности и др. (Villamiel М., Jong Р., 2000). Например, для обработки сырого коровьего молока использовали УЗ-генератор с постоянной частотой – 20 кГц при использовании различных уровней амплитуд – 0, 20, 40, 60 и 80 % (соответственно 90, 180, 270 и 360 вт) с экспозицией 30, 60, 90 и 120 с при 20 и 40°С. На рис. 48 показано значительное снижение активностей ферментов молока – лактопероксидазы и щелочной фосфатазы, при этом в первом случае снижение активности было несколько в большей степени, чем во втором. Наиболее высокая инактивация этих ферментов отмечена при амплитуде в 80% и 40 °С и наименьшая – при амплитуде 20% и 20 °С (Ertugay M.F., Yüksel Y., Sengül M., 2003).
В табл. 64 приведены данные по влиянию УЗ-обработки совместно с тепловой обработкой цельного и обезжиренного молока на активность лактопероксидазы (ЛП), щелочной фосфатазы (ЩФ) и γ-глутамилтранспептидазы (γ-ГТП) с использованием специального аппарата с параметрами: частота – 20 кГц, амплитуда – 120 мкм, при 150 Вт и скорость течения молока – 11...28 мл/мин. Если активность лактопероксидазы в исходном цельном молоке составляла в среднем 0,90 ед./мл, то при 75,5 °С с выдержкой 102,3 с она снизилась на ≈ 37 %, только при УЗ-обработке – на ≈ 14 и при совместной обработке – почти на 70 %. В то время как в обезжиренном молоке при УФ-обработке активность фермента была полностью не инактивирована, при тепловой обработке – 75,5 °С инактивация фермента была подобной цельному молоку, а при совместной обработке ее активность снизилась на 53 %. При активности щелочной фосфатазы в исходном цельном молоке 4030, а в обезжиренном молоке – 2196 мкг фенола/мл, тепловая обработка при 61 °С с выдержкой 56,3 с снижала ее в обоих видах молока на 24 %, а полная инактивация отмечена при 75,5 °С с выдержкой 102,3 с. В то же время, одна УЗ-обработка не инактивировала, практически, этот фермент молока, а при совместной обработке инактивация составила, практически, одинаково ≈ 45 % при 61 °С, а при других режимах ≈ 100 %. Что касается γ-глутамилтранспептидазы, то при только тепловой и совместной обработкам при 75,5 °С с выдержкой 102,3 с ее активность была инактивирована, практически, полностью в обоих видах молока. Таким образом, наиболее лабильной при тепловой (75,5 °С) и совместной тепловой и УЗ-обработкам была щелочная фосфатаза и γ-глутамилтранспептидаза, и наиболее устойчивой при всех видах обработки молока была лактопероксидаза.
Таблица 64
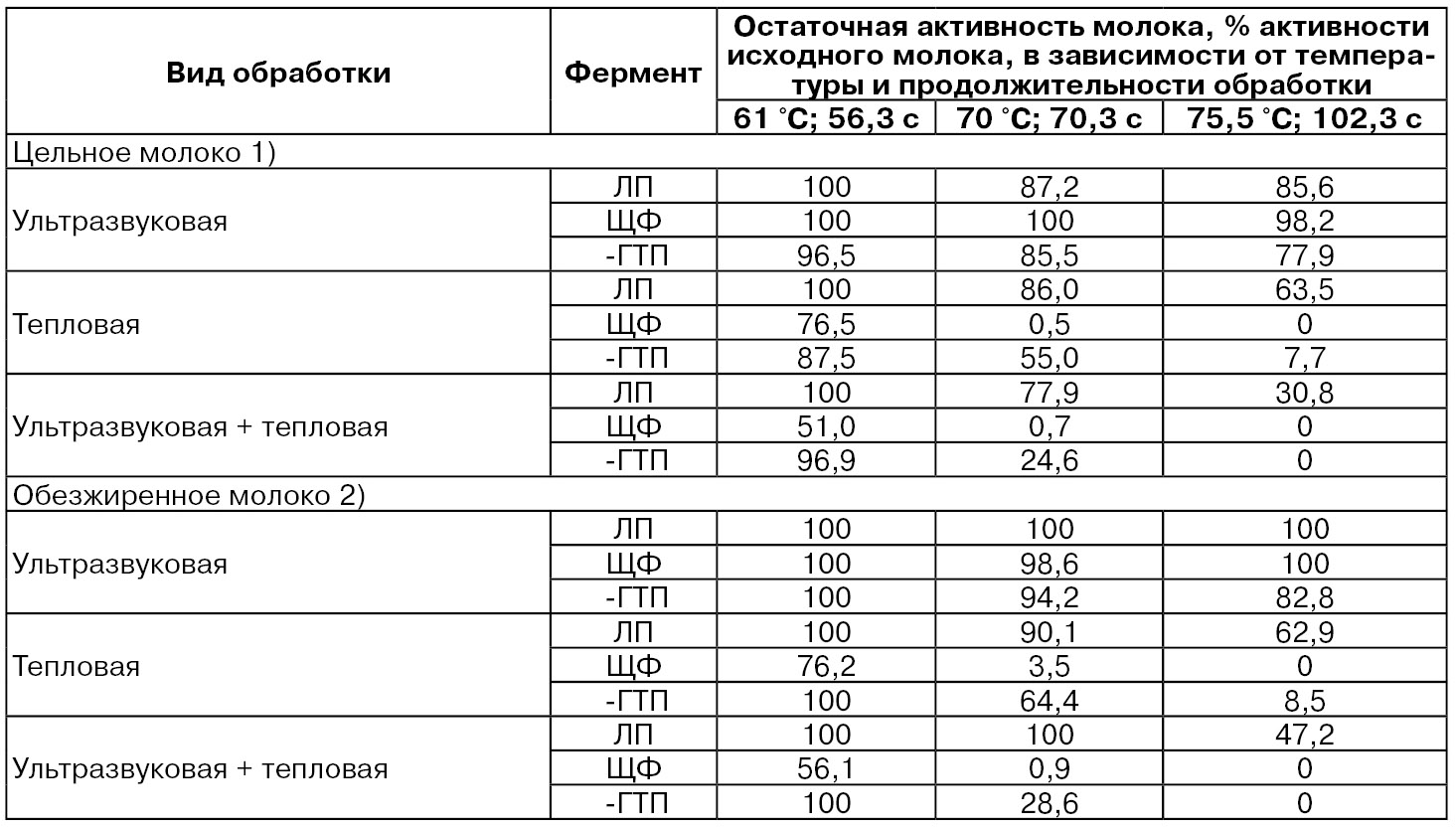
1) 1 – сборное цельное молоко, охлажденное и затем нагретое до 22,5...24,5 °С.
2) 2 – обезжиренное молоко, полученное при центрифугировании цельного молока при 3800 g в течение 15 мин при 4 °С.
Сообщается, что УЗ-воздействие совместно с тепловой обработкой на ферменты молока может происходить в результате повышения чувствительности активных центров ферментов для тепловой инактивации. Дополнительно, увеличение температуры тепловой обработки снижает вязкость продукта и силу, необходимую для разрушения образующихся пузырьков (Villamiel М., Jong Р., 2000).
Имеются данные по импульсной обработке молока в электрическом поле и влияние ее на протеиназу молока. Так, при внесении 100 мкг плазмина/мл в ультрафильтрат модельного молока (при рН 6,11 и ионой силе 0,056 М) и выдерживании этой смеси при 10 и 15 °С в импульсных электрических полях при напряжении электрического поля 15, 30 и 45 кВ/см и числе импульсов 10, 20, 30, 40 и 50, степень инактивации плазмина зависела от количества импульсов, интенсивности электрического поля и температуры обработки. Так, при напряжении электрического поля 30 и 45 кВ/см и 15 °С активность плазмина снижалась на 90 % после 50 импульсов, что показывает возможность использования импульсных электрических полей для инактивации протеолитических ферментов (Vega-Mercado Н., Powers J. R., Barbasa-Canovas G., 1995).
Сообщается и о влиянии радиации на ферменты молока (Eitenmiller R. R., Barnhart Н. М., Shahani К. М.). Отмечено, что радиация оказывает как ингибирующее действие на ферменты молока, так и активирующее, что видно из нижеприведенных в табл. 65 данных (Ismaill A. A. et al.).
Ультрафильтрация. В молочной промышленности находит широкое применение ультрафильтрация молока. В связи с этим, представляет интерес влияние ультрафильтрации на тепловую инактивацию ферментов молока. Показано, что когда в ультраконцентрат, полученный из обезжиренного пастеризованного молока с содержанием белка 6, 8, 10, 13 и 16 %, и в исходное обезжиренное молоко вносили равные количества щелочной фосфатазы с сырым молоком, а затем подвергали тепловой обработке при 63 °С в выдержкой 10, 20 и 30 мин, тепловая инактивация щелочной фосфатазы происходила быстрее в ультраконцентрате, содержавшем 16 % белка, чем в исходном обезжиренном молоке. Ультраконцентраты с пониженным содержанием белка мало отличались по остаточным концентрациям фермента от исходного обезжиренного молока. Добавление лактозы в 16%-ный белковый ультраконцентрат значительно увеличивало термостойкость щелочной фосфатазы. Таким образом, использование щелочной фосфатазы для определения эффективности пастеризации высокобелковых ультраконцентратов молока сомнительно (Mistry V. V., 1989).
Таблица 65
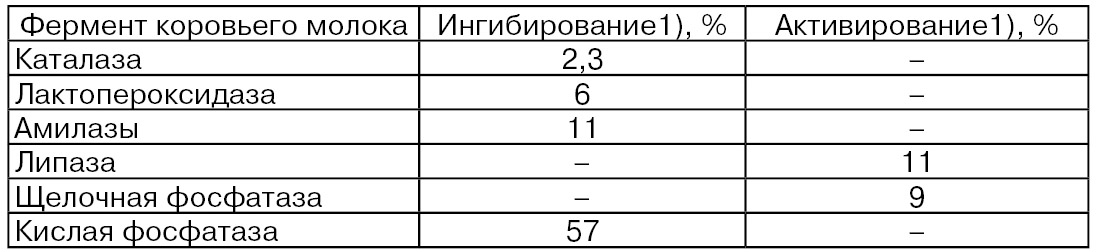
1) При дозе 0,5 Мрад/ч.