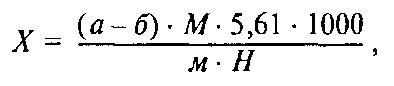Определение активности арил-, карбоксил- и холинэстераз. Сущность метода. Использование газометрического метода, основанного на гидролизе этими ферментами трибутирина. Образуемые СЖК при реакции с бикарбонатом натрия образуют диоксид углерода. Для того чтобы определить активность ферментов в отдельности, используют соответствующие ингибиторы (Shahani К. М., Harper W. J. et al.). Одна единица активности соответствует такому количеству фермента в 1 мл молока, которое катализирует реакцию со скоростью образования 1 мл диоксида углерода в течение 30 мин при принятых условиях проведения реакции.
Для определения активности арилэстеразы применяют титриметрический метод, сущность которого состоит в гидролизе этим ферментом фенилацетата, в результате чего образуется уксусная кислота, которую определяют титрованием раствором щелочи (Marquardt R. R. et al.).
Аппаратура, материалы, реактивы. Баня водяная с температурой нагрева (37 ± 1)°С; колбочки стеклянные вместимостью 50 мл и мерные вместимостью 100 мл; пипетки вместимостью 5; 10 мл; бюретки вместимостью 5; 10 мл; капельница; дигидро-орто-фосфат калия – 0,1 М раствор; фенилацетатная эмульсия – 0,3 М раствор (13,5 г фенилацетата и 6 г тритона Х-155 растворяют в мерной колбочке вместимостью 100 мл, в которую пипеткой отмеривают 8 мл аравийской камеди – 2,5 % в/об. и доводят объем до метки водой); NaOH – 0,1 или 0,2 н. раствор; фенолфталеин – 0,1%-ный спиртовой раствор; вода дистиллированная.
Ход определения. В колбочку (рабочую) вместимостью 50 мл отмеривают 5 мл 0,1М раствора дигидро-орто-фосфата калия и 5 мл молока (pH смеси 7,6...7,7) и помещают в водяную баню при (37 ± 1 )°С на 5 мин. Затем в ту же колбочку отмеривают 5 мл 0,3 М фенилацетатной эмульсии, перемешивают и помещают в ту же баню на 1,5 ч. Каждые 2,5 мин колбочку из бани вынимают и немедленно титруют ее содержимое 0,1 или 0,2 н. раствором NaOH в присутствии 0,1%-ного раствора фенолфталеина. Контрольной пробой служит молоко, нагретое до (80 ± 5)°С в течение 10 мин.
На основании полученных данных строят градуировочную кривую зависимости между количеством миллилитров раствора щелочи и продолжительностью титрования в минутах рабочей пробы за вычетом контрольной пробы. На прямом участке кривой определяют активность фермента. Единица активности соответствует количеству фермента, катализирующего реакцию со скоростью, определяемой числом микромолей фенилацетата, гидролизованного в течение 1 мин при 37 °С.
Определение активности липазы. Сущность метода. Выдерживание смеси молока с тем или иным субстратом и дальнейшее прямое титрование выделившихся СЖК (метод рН-стат) или титрование СЖК, экстрагированных из молока, различными органическими растворителями.
- I. Определение свободных жирных кислот в молоке методом рН-стат (Homer D. R., Virtanen А. I.; Шкинке В. Э.). Аппаратура, материалы, реактивы. рН-метр; автоматические датчики для потенциометрического титрования; центрифуга лабораторная с частотой вращения 3000 об/мин; баня водяная с температурой нагрева (37 ± 2)°С; термостатируемая стеклянная ячейка вместимостью 100 мл; пипетки вместимостью 5, 15 мл; микробюретки вместимостью 5, 10 мл; пробирки стеклянные вместимостью 30 мл; пробки резиновые № 16, 18; 0,025, 0,04, и 0,1 н. растворы КОН; трибутирин; азот в баллонах; вода дистиллированная.
Ход определения. В пробирку (рабочую) вместимостью 30 мл отмеривают 15 мл обезжиренного молока (полученного путем центрифугирования цельного молока при 3000 g и температуре 15...20°С) и помещают в водяную баню с температурой (37±2)°С на 10 мин. Затем в эту же пробирку отмеривают 5 мл трибутирина, закрывают пробкой и сильно встряхивают в течение 5 с. Полученную эмульсию помещают в стеклянную ячейку вместимостью 100 мл (термостатируемую водой при (37±2)°С), содержащую 15 мл воды, и ополаскивают пробирку 5 мл воды, помещая ее в ту же ячейку. В ячейку погружают электроды рН-метра, а над поверхностью пропускают азот со скоростью около 100 мл/мин. Путем добавления по каплям 0,025 и 0,1 н. растворов КОН достигают величины рН смеси реагентов, равной 8,8, и замечают время. Величину рН 8,8 поддерживают путем автоматического добавления к смеси реагентов по каплям 0,04 н. раствора КОН каждую минуту в течение 10 мин. Аналогично проводят контрольную пробу, но с молоком, подвергнутым тепловой обработке при 80 °С в течение 3 мин.
На основании полученных данных строят градуировочную кривую зависимости между числом миллилитров 0,04 н. раствора КОН и продолжительностью титрования в минутах рабочей пробы за вычетом контрольной пробы. На полученной кривой выбирают прямой участок и вычисляют активность липазы по следующей формуле:
где А – активность липазы, мл 0,04 н. КОН на 1 мл обезжиренного молока, мин; Vщ – количество 0,04 н. раствора КОН, израсходованное на титрование, за вычетом контрольной пробы, на прямом участке кривой, мл; VМ – количество молока, взятое для анализа, мл; t – время выбранного прямого участка кривой, мин.
Чувствительность метода достаточно высока и составляет 10...20 нэкв. СЖК/мин.
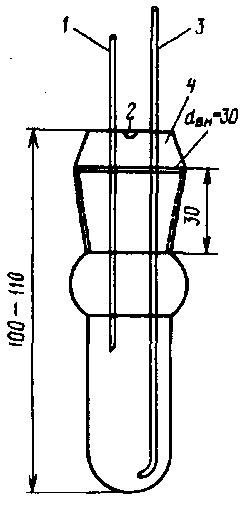
- II. Определение экстрагированных СЖК методом титрования (В. Г. Атраментова, 1978). Аппаратура, материалы, реактивы. Система для продувания воздухом, включающая компрессор для нагнетания воздуха и сосуды для концентрированной щелочи; пробирки стеклянные с притертыми пробками, градуированые, вместимостью 50 мл; пипетки градуированные вместимостью 1; 5 мл; микробюретка вместимостью 2...5 мл; специальная пробирка для титрования (рис. 60); изопропиловый спирт; гексан; Н2SO4 – 1 н. раствор; КОН – 0,005 н. раствор; крезоловый красный – 0,01%-ный спиртовой раствор; вода бидистиллированная. Раствор индикатора приготавливают в склянке из темного стекла и сохраняют в холодильнике.
Ход определения. В градуированную стеклянную пробирку (рабочую) вместимостью 50 мл отмеривают по 5 мл бидистиллята, молока и смеси изопропилового спирта, гексана и 1 н, раствора Н2SO4 (40:10:1). Пробирку закрывают притертой пробкой и энергично встряхивают в течение минуты. Затем в пробирку отмеривают 4 мл гексана и вновь также встряхивают. После разделения смеси на слои, которое происходит через 30 мин, из верхнего слоя отбирают 2...3 мл и переносят в пробирку для титрования. В эту же пробирку добавляют 0,3 мл 0,01%-ного спиртового раствора крезолового красного и титруют 0,005 н. раствором КОН до фиолетового окрашивания в потоке воздуха без углекислого газа. В холостой пробе молоко заменяют водой. Количество СЖК вычисляют по следующей формуле:
где X – количество СЖК в молоке, мг%; а – количество 0,005 н. КОН, пошедшее на титрование, мл; б – то же, для холостой пробы; М – количество отстоявшегося верхнего слоя, мл; 5,61 – пересчет на граммы КОН; м – количество отстоявшегося верхнего слоя, взятое на титрование, мл; Н – число нейтрализации кислоты, в пересчете на которую производится вычисление (для олеиновой кислоты Н = 198,75).
Рис. 60. Схема пробирки для титрования:
1 – капилляр для подачи щелочи, внутренний диаметр 1 мм; 2 – отверстие в головке пробки для выхода воздуха; 3 – трубка для подачи воздуха, внутренний диаметр 2 мм; 4 – стеклянная пробка со шлифом
Определение активности липопротеинлипазы. Сущность метода. Метод определения активности липопротеинлипазы отличается от метода определения активности липазы только видом субстрата, в частности, используют триглицерид – липопротеиновый комплекс.
Аппаратура, материалы, реактивы. Баня водяная с температурой нагрева (37 ± 1)°С; пробирки стеклянные вместимостью 10 мл; пипетки градуированные вместимостью 1, 2, 5 мл; эмульсия оливкового масла – 20 %; поливиниловый спирт – 2%-ный раствор; лиофилизированная сыворотка бычьей крови – 3%-ный раствор; буфер – 1,35 М раствор трис-НС1, рН 8,65; СаС12 – 1 М раствор; NaСl – 1 М раствор; NaОН – 0,01 н. раствор; вода дистиллированная.
Ход определения. В пробирку стеклянную вместимостью 10 мл отмеривают 2,5 мл обезжиренного молока, 3 мл специальной реакционной смеси, состоящей из 1,8 мл 20%-ной эмульсии оливкового масла в 2%-ном растворе поливинилового спирта, 0,5 мл 3%-ного раствора лиофилизированной сыворотки бычьей крови, 0,5 мл буферного раствора (1,35 М трис-НС1, рН 8,65) и 0,2 мл 1 М раствора СаС12. Реакционную смесь без молока предварительно активируют при (37 ± 1)°С в течение 1 ч. Реакцию проводят в водяной бане при (37 ± 1)°С в течение 1 ч. Параллельно ставят контрольный опыт с добавлением к реакционной среде 1 М раствора NaС1 для разделения липазной и липопротеинлипазной активностей. СЖК, образующиеся в результате гидролиза, экстрагируют той же смесью, что используют при определении активности липазы, и титруют 0,01 н. раствором NaОН. Активность фермента выражают количеством миллилитров щелочи, пошедшим на титрование (Лебедев А. Б., Уманский М. С., 1981).
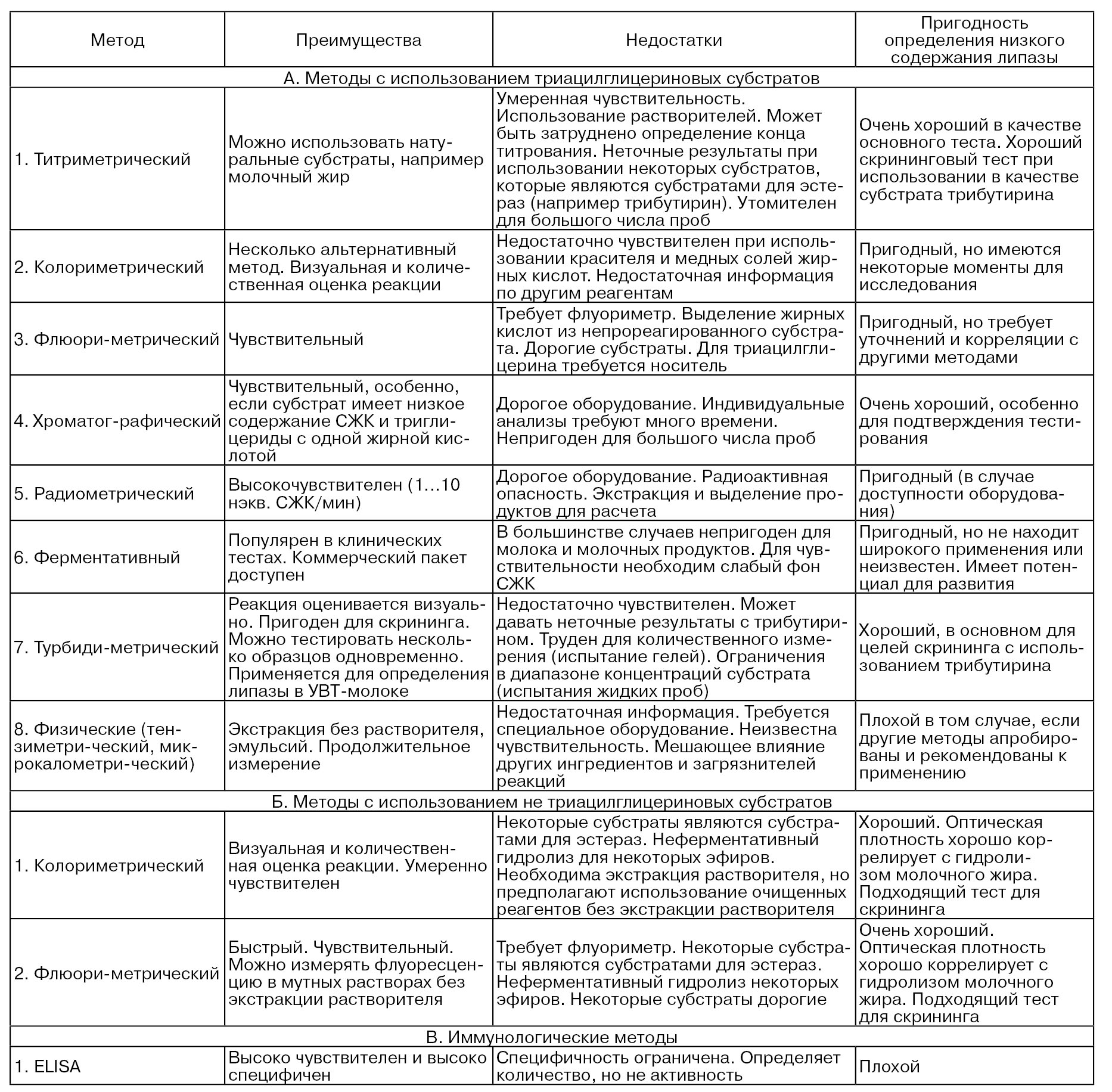
Ниже (табл. 77) приведены оценки методов определения активности липазы в молоке и молочных продуктах с обсуждением их положительных и отрицательных сторон, использования различных субстратов и чувствительности (по данным 2000 г.).
Различные методы определения СЖК, их преимущества и недостатки представлены в монографии ММФ «Определение СЖК в молоке и молочных продуктах» (Бюл. ММФ, 1991, № 265).
Таблица 77
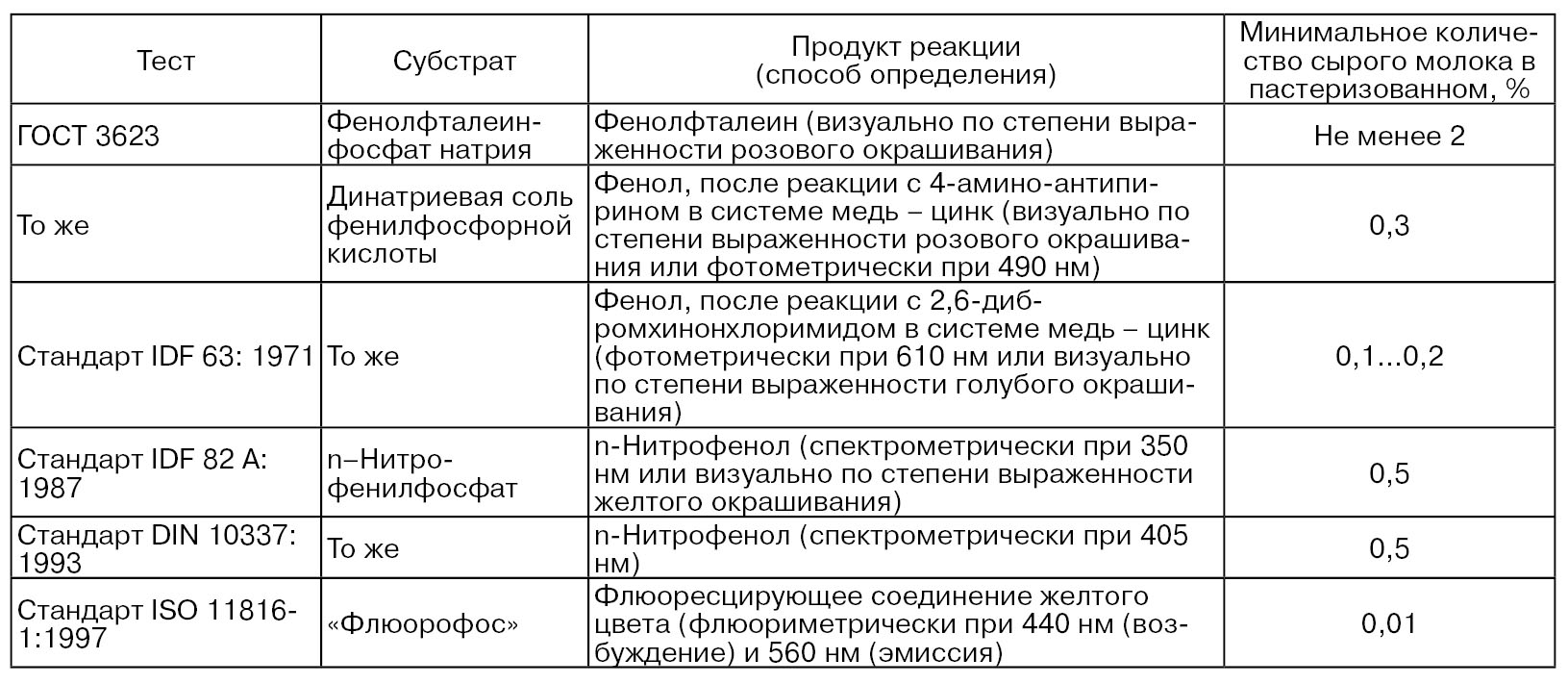
Определение активности щелочной фосфатазы. Сущность метода. Качественные и количественные методы обнаружения щелочной фосфатазы в молоке основаны на свойстве фермента катализировать гидролиз различных сложных эфиров фосфорной кислоты. В табл. 78 приведены субстраты, продукты измерения и чувствительности методов определения активности щелочной фосфатазы.
Таблица 78
Качественный метод определения активности щелочной фосфатазы (ГОСТ 3623).
- I. С использованием субстрата – фенолфталеин-фосфата натрия. Метод основан на гидролизе фенолфталеин-фосфата натрия щелочной фосфатазой, содержащейся в молоке (молочных продуктах). Освобождающийся при гидролизе фенолфталеин в щелочной среде дает розовое окрашивание, степень которого оценивают визуально.
При отсутствии фермента цвет смеси молока (молочных продуктов) с реагентами не изменяется. Следовательно, молоко (молочные продукты) подвергались пастеризации при температуре не ниже 63 °С с выдержкой не менее 30 мин. При наличии фосфатазы цвет смеси приобретает окрашивание от светло-розового до ярко-розового. Следовательно, молоко (молочные продукты) не подвергались пастеризации или подвергались пастеризации при температуре ниже 63 °С, или с выдержкой менее 30 мин, или были смешаны с непастеризованным молоком (молочными продуктами).
Чувствительность метода позволяет обнаружить добавление не менее 2 % непастеризованных молока (молочных продуктов) к пастеризованным.
- С использованием субстрата – динатриевой соли фенилфосфорной кислоты (арбитражный метод). Метод основан на гидролизе динатриевой соли фенилфосфорной кислоты щелочной фосфатазой, содержащейся в молоке (молочных продуктах). Выделившийся при гидролизе свободный фенол в присутствии окислителя дает розовое или красное окрашивание с 4-аминоантипирином в системе медь – цинк, степень которого оценивают визуально.
При отсутствии фермента смесь молока (молочных продуктов) с реагентами (раствора, отделившегося от осажденного белка в системе медь – цинк) бесцветная, аналогично контрольной пробе с кипяченым молоком. Следовательно, молоко (молочные продукты) подвергались пастеризации при температуре не ниже 63 °С с выдержкой не менее 30 мин. При наличии фосфатазы раствор приобретает окрашивание от розового до темно-красного. Следовательно, молоко (молочные продукты) не подвергались пастеризации, или были пастеризованы при температуре ниже 63 °С или с выдержкой не менее 30 мин, или были смешаны с непастеризованным молоком (молочными продуктами).
Чувствительность метода позволяет обнаружить добавление непастеризованного молока (молочных продуктов) к пастеризованному: 0,3 % в молоке, сливках, кисломолочных напитках; 0,5 % в твороге и сметане и 1 % в напитках с плодово-ягодными наполнителями и сыворотке.
Количественный метод определения активности щелочной фосфатазы.
- С использованием субстрата – динатриевой соли фенилфосфорной кислоты. Метод основан на колориметрировании цветного соединения фенола, выделившегося при гидролизе динатриевой соли фенилфосфорной кислоты фосфатазой молока, в присутствии окислителя с 4-аминоантипирином в системе цинк – медь. Активность фермента выражают количеством фенола (в мкг/мл молока), определенным по величине оптической плотности с помощью градуировочной кривой (Серебренникова В. А, Патратий А. П., Рашкина Н. А., 1978).
Аппаратура, материалы, реактивы. То же, что и в качественном методе определения активности щелочной фосфатазы по ГОСТ 3623, и дополнительно: фотоэлектроколориметр лабораторный со светофильтром 490 нм; колбы мерные вместимостью 100; 1000 мл; пипетки градуированные вместимостью 1; 10 мл; фильтры бумажные обеззоленные диаметром 5...7 см; фенол; вода дистиллированная.
Ход определения. Проведение анализа до получения фильтрата подобно качественному методу по ГОСТ 3623. Для получения фильтрата содержимое пробирок рабочей и контрольной проб после выдержки в водяной бане в течение 10 мин охлаждают до (20 ± 2)°С и фильтруют через обеззоленный бумажный фильтр. Затем измеряют оптическую плотность фильтрата против фильтрата контрольной пробы с кипяченым молоком на фотоэлектроколориметре при 490 нм. По величине оптической плотности, используя градуировочную кривую, определяют количество фенола (в мкг/мл молока).
Построение градуировочной кривой. Для приготовления стандартных фенольных растворов растворяют 1 г фенола в мерной колбе вместимостью 1000 мл (1 мл этого раствора содержит 1 мг фенола). Затем 1 мл этого раствора отмеривают пипеткой в мерную колбу вместимостью 100 мл и доводят до метки водой (1 мл полученного раствора содержит 10 мкг фенола). Далее из этого раствора готовят растворы, содержащие 0,5, 1, 2, 5 и 10 мкг фенола в 1 мл. С каждым стандартным раствором проводят реакцию на щелочную фосфатазу по методике качественного метода, взяв в реакцию вместо молока стандартный раствор фенола, с последующим измерением оптической плотности фильтратов. Чувствительность определения составляет 0,5 мкг фенола на 1 мл.
Наряду с преимуществами способа контроля пастеризации по активности щелочной фосфатазы возможны случаи, затрудняющие его, например появление положительной реакции на фосфатазу в пастеризованном молоке (сливках) в результате реактивации фермента. В связи с этим разработан способ дифференцированного определения наличия в молоке реактивированной щелочной фосфатазы,
- II. С использованием субстрата – органического эфира фосфорной кислоты. Сущность метода. Флюоресцирование свободной фосфорной кислоты, образующейся при гидролизе органического эфира фосфорной кислоты щелочной фосфатазой.
Аппаратура, материалы, реактивы. Флюориметр (Fluorophos. – модель FLM-200, США) со светофильтром 405 нм; термостат с регулируемой температурой от 0 до 50 °С; дозатор – 100 мкл; пипетка градуированная вместимостью 5 мл; органический эфир фосфорной кислоты; буфер, содержащий диметилформамид, рН 5,0 (хранят в холодильнике); буферный раствор субстрата – приготавливают смешиванием приготовленного субстрата со стандартным объемом буфера, рН 5,0, содержащего диметилформамид; вода дистиллированная.
Ход определения. В пробирку флюориметра отмеривают 2 мл раствора образца молока и выдерживают в термостате при 37 °С в течение 5 мин. Затем дозатором в ту же пробирку отмеривают 75 мкл раствора буферного субстрата и перемешивают вручную или с использованием вортекса. Далее пробирку помещают в прободержатель флюориметра и измеряют флюоресценцию со светофильтром 405 нм.
Продолжительность измерения составляет около 3 мин. Активность фермента выражают во флюорофосных единицах/л. Измерение можно проводить при использовании 150 и 225 мкл образца молока.
Метод позволяет обнаружить примесь сырого молока в пастеризованном молоке до 0,003 % (Harding F., 1991; Lechner Е., 1996).
Дифференцированный способ определения активности реактивированной щелочной фосфатазы. Сущность метода. В молоке (и сливках), подвергнутом тепловой обработке, реактивированная щелочная фосфатаза, в отличие от остаточной щелочной фосфатазы, имеет свойство в 8...14 раз повышать свою активность при добавлении к молоку ионов магния и дальнейшей инкубации его при 34 °С в течение 1 ч.
Аппаратура, материалы, реактивы. Баня водяная с температурой нагрева (34 ± 1)°С; плитка электрическая обычная; стаканчики стеклянные вместимостью 100 мл; пробирки стеклянные вместимостью 20 мл; пипетки вместимостью 1 мл (градуированные), 5; 10 мл; цилиндр вместимостью 50, 100мл; хлорид магния (100 г растворяют в 25 мл воды, слегка подогревая, и количественно переносят в мерную колбочку вместимостью 100 мл, охлаждают до (20 ± 2)°С и доводят до метки водой); вода дистиллированная.
Подготовка контрольных образцов. В стаканчик отмеривают 50 мл молока (сливок) и подвергают кипячению, затем охлаждают и используют в качестве контрольного образца для разведения образцов с добавленным хлоридом магния.
Ход определения. В две стеклянные пробирки вместимостью 20 мл отмеривают по 10 мл пастеризованного молока (сливок) и к одной из них добавляют раствор хлорида магния в количестве, зависящем от содержания жира в продукте: 0,40 мл при 3...7%, 0,35 мл при 8...12, 0,30 мл при 13...18, 0,25 мл при 19...25, 0,20 мл при 26...31 и 0,15 мл при 32...40% жира. Пробирки выдерживают в водяной бане при температуре (34 ± 1)°С в течение 1 ч. Далее в стеклянную пробирку вместимостью 20 мл отмеривают 1 мл молока (сливок) из пробирки, содержащей хлорид магния, и 5 мл кипяченого молока (сливок), где щелочная фосфатаза полностью инактивирована, и определяют активность реактивированной щелочной фосфатазы описанным выше количественным методом в сравнении с активностью щелочной фосфатазы в молоке (сливках), не содержащем хлорида магния. Если разбавленное молоко (сливки), содержащее хлорид магния, имеет такую же или большую активность, чем неразбавленное и не содержащее хлорид магния, реакция считается отрицательной и указывает на то, что присутствует реактивированная фосфатаза. Если разбавленное молоко менее активно, чем неразбавленное, реакция на остаточную фосфатазу будет положительной.
Активность кислой фосфатазы. Активность кислой фосфатазы определяют тем же методом, что и активность щелочной фосфатазы по качественному методу II, но при pH буфера 4,8...5,0.
При полной инактивации кислой фосфатазы в молоке (сливках), окраска опытных проб отличается от окраски контрольных проб. Следовательно, молоко (сливки) подвергались пастеризации при температуре 85 °С с выдержкой не менее 30 мин, 90 °С с выдержкой не менее 5 мин или кипячению; сливки при температуре 103 °С с выдержкой 15...20 с. В зависимости от активности кислой фосфатазы в молоке (сливках), опытные пробы имеют цвет от слабо-розового, но более яркого, чем окраска контрольных проб, до темно-вишневого. Следовательно, наличие активности кислой фосфатазы свидетельствует о несоблюдении режимов термической обработки молока (сливок).
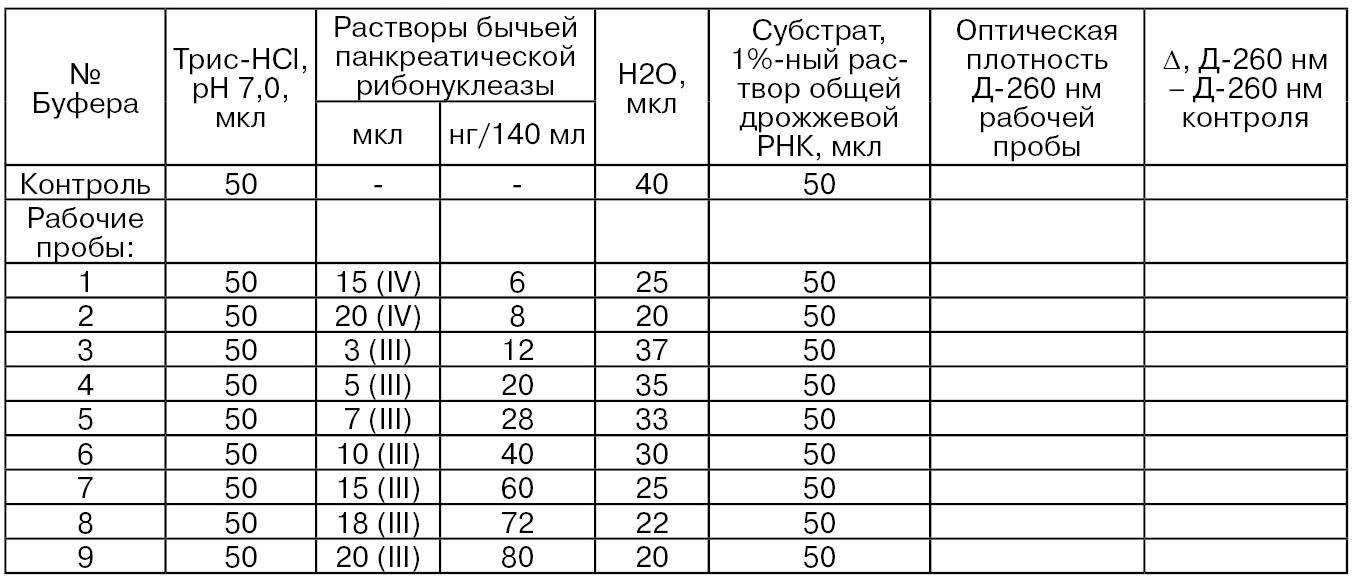
Определение активности рибонуклеазы (панкреатической). Активность рибонуклеазы в молоке обычно определяют спектрофотометрическим методом, сущность которого состоит в том, что при гидролизе этим ферментом РНК и олигонуклеотидов оптическая плотность раствора с продуктами реакции, по сравнению с исходным раствором, уменьшается. Измерение проводят при 260 нм.
- Аппаратура, материалы, реактивы. Спектрофотометр со светофильтром 260 нм; баня водяная с температурой нагрева (37 ± 1)°С; фильтр обеззоленный; пробирки стеклянные вместимостью 10 мл; пипетки вместимостью 1 мл; пипетки градуированные вместимостью 10 мл; натриевая соль РНК (из дрожжей) 1%-ный раствор в 0,2 М Трис буфере (рН 7,8), содержащем 1 ммоль ЭДТК; осадитель, содержащий в 1 л 30 г сернокислого цинка (семиводный) и 6 г сернокислой меди; вода дистиллированная.
Ход определения. В стеклянную пробирку вместимостью 10 мл отмеривают 1 мл молока (немного разбавленного) и 1 мл 1%-ного раствора натриевой соли РНК (содержание натриевой соли в 1 мл реакционной смеси может составлять 2,5...5,0 мг/мл), смесь выдерживают на водяной бане при (37 ± 1)°С в течение 30 мин. Затем к смеси добавляют 3 мл осадителя, выдерживают 10 мин и фильтруют через бумажный обеззоленный фильтр. Полученный фильтрат разбавляют водой в 10 раз и измеряют оптическую плотность на спектрофотометре при 260 нм, по сравнению с фильтратом контрольной пробы, в которую молоко добавляют перед внесением осадителя в реакционную смесь.
Активность рибонуклеазы выражают в % от исходной активности, или в % образовавшегося растворимого фосфора (Bingham E. W., Zittle C.A.), или в оптической плотности при 260 нм (Fumio J. et al.), либо определяют по градуировочной кривой, построенной с использованием очищенной панкреатической рибонуклеазы (Сайкаускене В., 1987).
- II. Аппаратура, материалы, реактивы. Спектрофотометр («Specord М-40») со светофильтром 260 нм; баня водяная с температурой нагрева (25 ± 1) и (37 ± 1)°С; центрифуга «МРW-310» с частотой вращения 15000 об/мин; набор полипропиленовых пробирок вместимостью 1,5 мл; пробирки стеклянные градуированные вместимостью 10 мл; дозаторы на 10, 50, 100 мкл; 0,2 М Трис-НС1 буфер (рН 7,0), уранилацетат – 0,75%-ный раствор, содержащий 25%-ный раствор хлорной кислоты; общая дрожжевая РНК – 1%-ный свежеприготовленный водный раствор; бычья панкреатическая рибонуклеаза (400 нг/мл); вода бидистиллированная.
Ход определения. В полипропиленовую пробирку вместимостью 1,5 мл отмеривают 50 мкл 0,2 М Трис-буфера (рН 7,0), 10 мкл молока, доводят общий объем до 140 мкл бидистиллированная водой и выдерживают на водяной бане при (25 ± 1)°С 2...3 мин. Реакцию инициируют добавлением 50 мкл 1%-ного свежеприготовленного водного раствора общей дрожжевой РНК. Затем пробирку выдерживают на водяной бане при (37 ± 1)°С в течение 15 мин. Реакцию останавливают добавлением в пробирку 60 мкл 0,75%-ный раствора уранилацетата, содержащего 25%-ный раствор хлорной кислоты. Содержимое пробирки перемешивают и оставляют во льду на 25 мин и затем центрифугируют при 4 °С (15 000 об/мин, 5 мин). В полученном супернатанте, разбавленном в 30 раз водой, измеряют оптическую плотность на спектрофотометре при 260 нм.
Содержание панкреатической рибонуклеазы (в мкг/мл) определяют по градуировочной кривой.
Построение градуировочной кривой. Используют вышеописанный ход определения панкреатической рибонуклеазы в молоке, но вместо молока используют бычью панкреатическую рибонуклеазу.
Дополнительные реактивы: 0,1%-ный раствор натрия хлорида; 0,1%-ный раствор бычьего сывороточного альбумина.
Ход определения. Навеску бычьей панкреатической рибонуклеазы (4 мг) растворяют в 10 мл раствора, содержащего 0,1%-ный раствор бычьего сывороточного альбумина и 0,1%-ный раствор натрия хлорида. Далее разведения проводят по следующей схеме (см. табл. 79):
- Основной раствор бычьей панкреатической рибонуклеазы – 0,4 мг/мл.
- 1 мл раствора I + 9мл 0,1%-ных растворов бычьего сывороточного альбумина и натрия хлорида – 0,04 мг/мл.
- 1 мл раствора II + 9 мл 0,1%-ных растворов бычьего сывороточного альбумина и натрия хлорида – 0,004 мг/мл.
- 1 мл раствора III + 9 мл 0,1%-ных растворов бычьего сывороточного альбумина и натрия хлорида – 400 нг/мл.
Для построения градуировочной кривой на оси абсцисс откладывают концентрацию растворов бычьей панкреатической рибонуклеазы, нг/140 мл, а по оси ординат – разницу оптических плотностей – Д-260 нм – Δ между рабочей пробой и контроля и отмечают прямой участок (Тихомирова Н. А., Комолова Г. С., Ионова И. И., 2004).
Таблица 79
Содержание ангиогенина в молоке определяют двумя методами. Первый метод основан на конкурентной реакции связывания ангиогенина и панкреатической рибонуклеазы с их плацентарным ингибитором. Так как ангиогенин по сравнению с рибонуклеазой обладает бóльшей скоростью связывания с ингибитором, то это приводит к распаду комплекса с высвобождением рибонуклеазы, активность которой можно определить. Однако при исследовании образцов с высокой концентрацией рибонуклеазы использование данного метода ограничено из-за значительного расхода дорогостоящего препарата ингибитора. В коровьем молоке содержится 12...32 мг/мл рибонуклеазы, что на порядок выше содержания в нем ангиогенина. В связи с этим необходима предварительная очистка молока от рибонуклеазы. Опыты с модельными системами, максимально приближенными по физико-химическим показателям к коровьему молоку, показали, что достаточно эффективно очищает образцы молока от рибонуклеазы голубая агароза. Оптимизация условий (рН, ионная сила, концентрация рибонуклеазы) хроматографической очистки молока от рибонуклеазы на голубой агарозе позволяет минимизировать потери ангиогенина (Рогов И. А., Шалыгина А. М. и др., 1997).
Второй метод – иммуноферментный с использованием коньюгата поликлональных антител с лактопероксидазой хрена, которые специфичны к ангиогенину и не связываются с рибонуклеазой. В качестве субстрата используют реактив АБТС. С использованием градуировочной кривой по оптической плотности при 450 нм продукта пероксидазного окисления АБТС определяют концентрацию ангиогенина. Чувствительность этого метода составляет 10 нг/мл) (Рустамьян Ю. Л., Шалыгина А. М. и др., 1999; Комолова Г. С, Федорова Т. В., 2002; Рустамьян Ю. Л., 2005).
В связи с достаточной сложностью указанных методов определения ангиогенина, их использование рекомендовано при научно-исследовательских работах.
Определение активности дезоксирибонуклеазы. Сущность метода. Визуальное или спектрометрическое определение продуктов гидролиза полидезоксирибонуклеотидов ДНКазой.
Качественный метод определения активности ДНКазы состоит в использовании модифицированного (NaCI и СаС12) толуидинового голубого ДНК агара, рН которого доводят 0,1 М ацетатным буфером до величины 5,5, а ЭДТК добавляют до конечной концентрации в агаре 10-4 М.
Подготовленный агар подвергают тепловой обработке при 100°С. Образцы молока помещают в углубления (d = 10 мм) в 2 мм слое агара и после определенного времени отмечают величину зоны диффузии, которая зависит от количества и активности ДНКазы в образце молока. Активность ДНКазы в молоке выражают условно в диффузных единицах/0, 1 мл.
Количественный метод определения активности ДНКазы предусматривает предварительное концентрирование молока, заключающееся в использовании сернокислого аммония до 40%-ного насыщения и дальнейшего центрифугирования. Далее супернатант насыщают до 80% сернокислым аммонием и после центрифугирования полученный осадок растворяют в дистиллированной воде и диализируют против воды.
Реакционная смесь содержит: 1 мл нативной ДНК (150 мг/100 мл); 1 мл 0,1 М ацетатного буфера (рН 5,5) и 1 мл раствора сырой ДНКазы. Раствор ДНК содержит 10-3 М ЭДТК. Реакционную смесь выдерживают при 30°С в течение 30 мин и затем реакцию прекращают добавлением 1 мл 5%-ного ТХК. После центрифугирования при 40 000 об/мин в течение 20 мин измеряют абсорбцию супернатанта при 260 нм и в т. ч. в 2 раза разбавленного по сравнению с контрольной пробой, к которой ТХК добавляют к раствору сырого фермента (Gudding R..; 1979).
Определение активности амилазы. Сущность метода. Визуальная оценка или колориметрическое измерение степени гидролиза крахмала α-амилазой в молоке в присутствии йода. В результате гидролиза крахмала образуется в основном (75...80%) смесь декстринов (полисахаридов) различной молекулярной массой, олигосахариды (в основном мальтоза) и моносахариды (D-глюкоза).
Качественный метод определения активности α-амилазы. Аппаратура, материалы, реактивы. Баня водяная с температурой нагрева (37 ± 1)°С; пробирки стеклянные вместимостью 20 мл; пипетки градуированные вместимостью 1 мл; пипетки вместимостью 5; 10 мл; крахмал растворимый – 1%-ный раствор; йод-калиевый крахмал (3 г крахмала растворимого и 3 г йодата калия растворяют в 100 мл воды); уксусная кислота – 50%-ный раствор; бумажные обеззоленные фильтры диаметром 7...9 мм; вода дистиллированная.
Ход определения. В пять стеклянных пробирок вместимостью 20 мл отмеривают по 10 мл молока и последовательно 0,1; 0,2; 0,3; 0,4 и 0,5 мл 1%-ного раствора растворимого крахмала. Содержимое пробирок перемешивают, нагревают в водяной бане до (37 ± 1 )°С и выдерживают при этой температуре в течение 1 ч. Затем пробирки охлаждают, при помешивании отмеривают в них по 3 мл раствора йод-калиевого крахмала и по 5 мл 50 %-ного раствора уксусной кислоты и перемешивают. Через 1...2 мин содержимое пробирок фильтруют через сухой складчатый обеззоленный фильтр и отмечают визуально окраску фильтрата. В зависимости от активности α-амилазы и количества внесенного крахмала фильтрат имеет окрашивание от серо-желтого со слабо-розовым оттенком до сине-фиолетового.
Количественный метод определения активности α-амилазы. Аппаратура, материалы, реактивы. Фотоэлектроколориметр со светофильтром 650...660 нм; баня водяная с температурой нагрева (30 ± 1)°С; пробирки стеклянные вместимостью 20 мл; колбочки стеклянные вместимостью 100 мл; цилиндр вместимостью 100 мл; пипетки градуированные вместимостью 1 мл; крахмал растворимый – 1%-ный раствор; йод – 0,05%-ный раствор в 0,1 н. растворе соляной кислоты; вода дистиллированная.
Ход определения. В две стеклянные пробирки вместимостью 20 мл отмеривают по 10 мл 1%-ного раствора растворимого крахмала и выдерживают их в водяной бане с температурой (30 ± 1)°С в течение 5...10 мин. Затем, не вынимая пробирок из бани, в одну пробирку отмеривают 5 мл воды (холостая), а в другую 5...10 мл молока (рабочая) предварительно нагретого до (30 ± 1)°С и после быстрого перемешивания, выдерживают в водяной бане при (30 ± 1)°С в течение 10 мин. Затем пробирки вынимают, отбирают из них по 0,5 мл смеси в стеклянные колбочки вместимостью 100 мл с предварительно отмеренными 50 мл 0,05%-ного раствора йода в 0,1 н. НС1 и перемешивают. Холостой раствор приобретает синее окрашивание, а рабочий раствор – фиолетово-бурое (интенсивность окраски зависит от степени гидролиза крахмала). Затем фотометрически измеряют оптическую плотность полученных растворов при 650...660 нм.
Количество гидролизованного крахмала (в %) определяют по формуле
где Д1 – оптическая плотность холостого раствора, характеризующая количество взятого в реакцию крахмала (0,1 г); Д2 – оптическая плотность рабочего раствора.
Если крахмала гидролизовалось более 0,07 или менее 0,02 г, то анализ повторяют, используя меньшее или большее количество молока. Если количество гидролизованного крахмала находится в указанных пределах, полученные данные используют для определения декстриногенной активности молока. При этом единица активности соответствует количеству фермента, которое катализирует реакцию гидролиза 1 г крахмала в течение 1 ч при 30 °С.
Активность α-амилазы определяют и по количеству образовавшейся мальтозы при гидролизе крахмала, которую определяют химическим или колориметрическим методом (Рухлядяева А. П., Полыгалина Г. В., 1981).
Определение активности лизоцима. Турбидиметрический метод. Сущность метода. Измерение степени лизиса суспензии бактериальных клеток при выдерживании ее в смеси с молоком с помощью методов – диффузии в агар или турбидиметрическим. Однако турбидиметрический метод более точен и по продолжительности более чем в десять раз быстрее метода диффузии в агар. Поэтому ниже дано описание турбидиметрического метода.
В качестве тест-культуры применяют Micrococcus lysodeikticus, обладающий наибольшей чувствительностью к этому ферменту.
В качестве субстрата для определения активности лизоцима используют ацетоновый порошок Micrococcus lysodeikticus, приготовленный следующим образом: 24-х часовую культуру, выращенную в питательном бульоне (триптический гидролизат кильки – 10,05 г/л, хлорид натрия – 4,95 г/л, рН 7,0...7,2), центрифугируют (5000 об./мин, 15...20 мин); супернатант сливают, осадок бактерий осторожно ресуспендируют в 0,06 М фосфатном буфере (рН 6,2), промывают и центрифугируют при тех же условиях. К полученному осадку небольшими порциями добавляют ацетон, непрерывно помешивая, затем суспензию бактерий центрифугируют (5000 об./мин, 5...10 мин) и ацетон сливают. Процедуру повторяют еще раз. Осадок сушат на воздухе, предварительно подсушив током азота. Полученный ацетоновый порошок Micrococcus lysodeikticus растирают в ступке и хранят при температуре 10 °С. Использование ацетонового порошка этой тест-культуры упрощает процедуру и способствует стандартизации исследования.
Приготовление ацетонового порошка тест-культуры приведено в работе Тихомировой Н. А., Комоловой Г. С., Ионовой И. И. (2004 г.).
Качественный метод определения активности лизоцима. Аппаратура, материалы, реактивы. Фотоэлектроколориметр лабораторный со светофильтром 540 нм; баня водяная с температурой нагрева (37 ± 1)°С; фильтры бумажные обеззоленные диаметром 5…7 см; пробирки стеклянные вместимостью 20 мл; пипетки вместимостью 1,10 мл; сычужный фермент – 0,01%-ный раствор; вода дистиллированная.
Ход определения. Суспензию мертвых клеток М. lysodeikticus готовят так, чтобы через нее проходило ≈ 40% света при 540 нм. В пробирку отмеривают 1 мл сыворотки молока (к 10 мл молока добавляют 0,25 мл 0,01%-ного раствора сычужного фермента и фильтруют) и 10 мл бактериальной суспензии, перемешивают и определяют оптическую плотность смеси при 540 нм. Затем пробирку помещают в водяную баню при температуре (37 ± 1)°С на 2 ч, охлаждают и определяют оптическую плотность смеси при 540 нм. Различие в величинах оптических плотностей смеси до выдерживания в водяной бане и после выдерживания в ней, выраженное в процентах, принимают за величину активности лизоцима в молоке (Матусевич В. Ф., Битюков В. А., Дмитриев А. Ф.).
Количественный метод определения лизоцима. Аппаратура, материалы, реактивы. Фотоэлектроколориметр лабораторный со светофильтром 540 нм; центрифуга лабораторная с частотой вращения 2000 об./мин; баня водяная с температурой нагрева (37 ± 1)°С; фильтры бумажные обеззоленные диаметром 5...7 см; колбочки стеклянные плоскодонные вместимостью 200 мл; пробирки стеклянные вместимостью 20 мл; цилиндр вместимостью 100 мл; пипетки вместимостью 3,5 мл; лизоцим кристаллический яичный; 0,5%-ный раствор хлорида натрия; соляная кислота – 1 н. раствор; фосфатный буферный раствор 0,06 М, рН 6,24; вода дистиллированная.
Получение сыворотки молока. В стеклянную пробирку вместимостью 20 мл отмеривают по 5 мл молока и 0,5%-ного раствора хлорида натрия (для активации лизоцима), полученную смесь перемешивают и центрифугируют в течение 10 мин при частоте вращения 2000 об./мин. Верхний слой жира удаляют, а в оставшейся жидкости осаждают белки 1 н. раствором соляной кислоты (рН смеси 4,6) при 37 °С и охлаждают. Осадок удаляют центрифугированием при указанных выше условиях или отделяют на бумажном фильтре, а сыворотку используют для анализа.
Ход определения. Вариант I. Суспензию мертвых клеток М. lysodeikticus готовят в фосфатном буферном растворе (рН 6,24) так, чтобы через нее проходило 10...30% света при 540 нм. Затем в стеклянную пробирку вместимостью 10 мл отмеривают 3 мл свежеприготовленной суспензии М. lysodeikticus и 3 мл молочной сыворотки, перемешивают, выдерживают в водяной бане в течение 20 мин при (37 ± 1)°С и охлаждают. Разницу в величинах оптической плотности до и после выдерживания смеси принимают за степень лизиса, а содержание фермента определяют по градуировочной кривой.
Построение градуировочной кривой. Вариант I. В стеклянные колбочки вместимостью 200 мл отмеривают по 100 мл кипяченого и охлажденного молока, добавляют от 4 до 125 мкг яичного лизоцима и готовят указанным выше способом образцы молочной сыворотки. Затем в пробирки вместимостью 10 мл отмеривают соответственно по 3 мл сыворотки и суспензии М. lysodeikticus, перемешивают и определяют оптическую плотность при 540 нм. По величинам оптических плотностей и соответствующим им концентрациям лизоцима строят градуировочную кривую.
Ход определения. Вариант II. В стеклянную пробирку вместимостью 10 мл отмеривают 1,5 мл свежеприготовленной суспензии М. lysodeikticus, 0,5 мл 0,5%-ного раствора натрия хлорида и 1 мл молочной сыворотки, полученной, как описано выше, перемешивают и измеряют величину оптической плотности полученной смеси при 540 нм через 15 и 180 с.
Построение градуировочной кривой. Вариант II. Навеску ацетонового порошка М. lysodeikticus суспендируют в фосфатном буферном растворе (0,06 М, рН 6,24) так, чтобы через взвесь культуры проходило 10...30% света при длине волны 540 нм. Для приготовления рабочих растворов лизоцима растворяют 100 мг кристаллического яичного лизоцима в 100 мл фосфатного буферного раствора (0,06 М, рН 6,24), а затем из полученного раствора, содержащего 100 мкг лизоцима/мл, готовят рабочие разведения, необходимые для построения градуировочной кривой (табл. 80).
Таблица 80
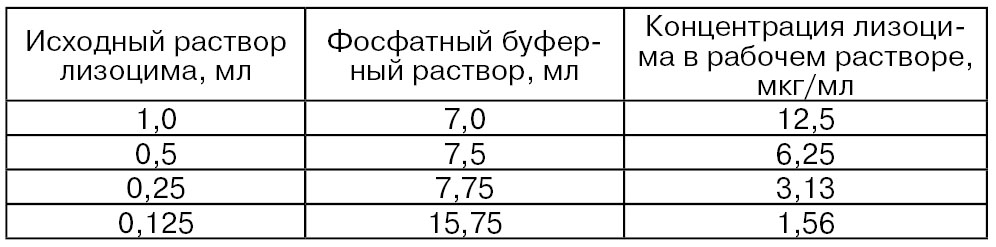
В кювету лабораторного фотоэлектроколориметра отмеривают 1,5 мл свежеприготовленной взвеси культуры, 0,5 мл 0,5%-ного раствора натрия хлорида (для активации лизоцима) и 1 мл раствора лизоцима определенной концентрации. Содержимое кюветы быстро перемешивают стеклянной палочкой и определяют оптическую плотность при 540 нм через 15 и 180 с. Контролем служит буферный раствор (0,06 М, рН 6,24), внесенный в кювету в количестве 3 мл. Для построения градуировочной кривой на оси абсцисс откладывают концентрацию лизоцима, мкг/мл, а на оси ординат – разницу величин оптических плотностей, полученных через 15 и 180 с (Тихомирова Н. А., Комолова Г. С., Ионова И. И., 2004).
Определение активности β-галактозидазы. В литературе отсутствует описание метода непосредственного определения активности этого фермента в молоке. Можно рекомендовать методы прямого определения освобождающихся при гидролизе лактозы моносахаридов, глюкозы и галактозы, например по методу Бертрана, по окислению глюкозы глюкозоксидазой до глюконовой кислоты. Эти методы высокоспецифичны, точны, но трудоемки.
Представляет интерес колориметрический метод, основанный на определении интенсивности окрашивания продуктов гидролиза некоторых хромогенных субстратов, например о-нитрофенил-β-D-галактозида. Этот метод предусматривает колориметрическое определение количества образовавшегося окрашенного продукта гидролиза о-нитрофенола. Единица активности соответствует такому количеству фермента, которое катализирует гидролиз 0,001 М раствора о-нитрофенил-β-D-галактозида. при рН 6,9 и 30 °С в присутствии 0,14 н. раствора фосфата натрия со скоростью 0,012 ммоль/мл реакционной смеси/мин. Метод достаточно точен и быстр, что позволяет рекомендовать его для проведения массовых анализов (Фениксова Р. В. и др.).
Определение активности N-ацетил-β-глюкозаминидазы. Сущность метода. При использовании в качестве субстрата n-нитрофенил-N-ацетил-β-D-глюкозаминида (или 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминида) флюориметрически по градуировочной кривой определяют продукты гидролиза указанных субстратов n-нитрофенола (или 4-метилумбеллиферона).
Аппаратура, материалы, реактивы. Флюориметр со светофильтром 410 нм; баня водяная с температурой нагрева 50 °С; центрифуга с частотой вращения 2000 об/мин; пробирки полиэтиленовые (150x15 мм) вместимостью 5 мл; пипетки градуированные вместимостью 1 мл; n-нитрофенил-N-ацетил-β-D-глюкозаминид – 3,33 ммоль раствор; буфер цитратный – 0,33 М раствор (рН 4,5), в котором приготавливают субстрат; буфер – 1 М глицин, содержащий 1% деоксихалат натрия (ДОК) (рН 10); хлороформ; вода дистиллированная.
Ход определения. В полипропиленовую пробирку вместимостью 5 мл отмеривают 0,2 мл цельного молока и 0,3 мл 3,33 ммоль раствора n-нитрофенил-N-ацетил-β-D-глюкозаминида, перемешивают, помещают в водяную баню с температурой нагрева 50 °С на 15 мин и охлаждают. После выдержки реакцию в пробирке останавливают путем добавления 1 мл 1 М глицина, содержащего 1% деоксихалат натрия (ДОК) (рН 10); добавляют 1 мл хлороформа, встряхивают 5 с и центрифугируют при частоте вращения 2000 об/мин в течение 10 мин.
Верхний водный слой удаляют пипеткой, проводят его флюориметрирование при 410 нм и, используя градуировочную кривую, определяют концентрацию образованного n-нитрофенола. Единица активности соответствует количеству фермента, которое катализирует реакцию со скоростью, измеряемой количеством n-нитрофенола мкмоль/мин/мл молока при 50 °С (Kitchen В. J., Middleton G. et al., 1984).
Определение активности протеаз. Сущность метода. Определение степени гидролиза белковых компонентов молока или специально добавляемых в молоко субстратов (например, хромогенные или флюорогенные соединения), к которым щелочные протеиназы проявляют высокую специфичность либо определение концентрации продуктов гидролиза различных азотистых соединений в определенных условиях выдерживания молока (В. Г. Авдеев, О. Я. Баширов; Шидловская В. П.; Humbert G., Alais С., 1979; Mottar J., Driessen F. M., 1987).
Определение активности щелочной протеиназы I с использованием флюорогенного соединения (Richardson В. С., Реаrсе К. N., 1981). Аппаратура, материалы, реактивы. Лабораторный флюоресцентный спектрометр со светофильтрами 380 и 460 нм; центрифуга лабораторная с частотой вращения 2000...3000 об./мин; баня водяная с температурой нагрева (25 + 1)°С; пипетки градуированные вместимостью 2 и 5 мл; дозаторы на 50, 100, 200, 1000 мкл; центрифужные пробирки вместимостью 10 мл; 7-амино-4-метил-кумарин; цитрат натрия – 0,4 M раствор; Трис-буфер – 0,05 M раствор, рН 7,5; диметил-сульфоксид; н-сукцинил-L-аланил-L-фенилаланил-L-лизил-7-амидо-4-метил-кумарин или кумарин-пептид – 1 ммоль раствор (7,5 г растворяют в 2 мл диметилсульфоксида и 8 мл 0,05 M раствора Трис-буфера, рН 7,5); вода дистиллированная.
Подготовка образца. В центрифужную пробирку вместимостью 10 мл отмеривают 3 мл молока и 1 мл 0,4 M раствора цитрата натрия и центрифугируют при частоте вращения 2000...3000 об./мин в течение 10 мин. В супернатанте определяют активность фермента.
Ход определения. В кювету флюоресцентного спектрометра отмеривают 50 мкл супернатанта молока и доводят объем до 640 мкл 0,05 M раствором Трис-буфера, рН 7,5. Содержимое кюветы перемешивают и нагревают в водяной бане до (25 + 1)°С с выдержкой 5 мин. Затем в ту же кювету отмеривают 160 мкл 1 ммоль раствора кумарин-пептида и флюориметрируют при длине возбуждения и эмиссии соответственно 380 и 460 нм. По величине оптической плотности смеси супернатанта молока и реагентов, используя градуировочную кривую, определяют концентрацию образованного 7-амино-4 метил-кумарина (АМК).
Единица активности соответствует количеству фермента, катализирующего реакцию со скоростью образования 1 ммоль АМК в течение 1 мин при 25 °С. Для построения градуировочной кривой ежедневно приготавливают растворы АМК с концентрацией от 4 до 4 · 10-7 моль.
Определение активности щелочной протеиназы I с использованием хромогенного соединения (Rollema H. S., Visser S. et al., 1983; Korycka-Dahl M. et al., 1983). Аппаратура, материалы, реактивы. Спектрофотометр лабораторный со светофильтром 405 нм; центрифуга лабораторная с частотой вращения 5000 об/мин; баня водяная с температурой нагрева (37 + 1)°С; микропипетки градуированные вместимостью 25, 50, 100, 250 мкл; Трис-НС1 – буферный раствор (рН 7,4), содержащий хлорид калия, ЭДТК, έ-амино-гексановую кислоту и н-D-валил-L-лейцил-L-лизил-4-нитроанидид (конечная концентрация в реакционной смеси соответственно 40, 40, 100, 50 и 0,6 ммоль).
Подготовка образца. Обезжиренное молоко получают путем центрифугирования цельного молока при частоте вращения 5000 об./мин в течение 20 мин при комнатной температуре.
Ход определения. Подготавливают реакционную смесь, состоящую из 25 мкл обезжиренного молока, разбавленного до 250 мкл Трис-HCl буферным раствором (рН 7,4) с добавленными компонентами (см. выше). Измерение оптической плотности полученной смеси молока с реагентами производят на спектрофотометре 405 нм в кювете 1 см при 37 °С в течение 15 мин. На основании полученных данных по величинам оптической плотности и продолжительности измерения в минутах строят градуировочную кривую и, выбирая прямой участок, определяют количество гидролизованного хромогенного соединения. Изменение оптической плотности смеси молока с реагентами в единицу времени принимают за 1 ед. активности фермента. Эта активность соответствует количеству фермента, катализирующему реакцию со скоростью распада субстрата 0,1 ммоль/мин при 37 °С, измеряемой по изменению на 1,0 величины оптической плотности смеси молока с реагентами.
Степень протеолиза молока, характеризующая активность его протеолитических ферментов, определяют не только по каким-либо отдельным продуктам протеолиза, но и по более общим показателям, таким, как общие и растворимые азотистые соединения, в том числе небелковые, протеозы, пептоны и др. Определение этих соединений производят до и после выдерживания молока в течение 1...3...5 дней при 37 °С с каким-либо консервантом. Общие растворимые, и в том числе небелковые, азотистые соединения определяют по методу Кьельдаля, а протеозо-пептонную фракцию – методом нефелометрии. Для осаждения белков используют соответственно при определении общих растворимых азотистых соединений 10%-ный раствор уксусной кислоты и небелковых – 15%-ный раствор ТХК. Протеолитическую активность выражают в абсолютных количествах или в относительных процентах прироста тех или иных азотистых соединений.
Определение протеозо-пептонной фракции. Сущность метода. Получение протеозо-пептонной фракции и дальнейшей нефелометрии ее в смеси с раствором ТХК (в сумме протеозо-пептоны) и с раствором сульфата аммония (протеозы).
Аппаратура, материалы, реактивы. Фотоэлектроколориметр лабораторный со светофильтром 360 нм; баня водяная с температурой нагрева 95...100°С; пробирки стеклянные вместимостью 20 мл; колбочки стеклянные мерные вместимостью 50 мл; пипетки вместимостью 1, 5, 20 мл и градуированные вместимостью 2 мл; воронки стеклянные диаметром 5...7 см; фильтры бумажные обеззоленные диаметром 7 см; уксусная кислота – 10%-ный раствор; ацетат натрия – 1 н. раствор; ТХК – 30%-ный раствор; сульфат аммония – насыщенный раствор; вода дистиллированная.
Ход определения. В стеклянную мерную колбочку вместимостью 50 мл отмеривают 20 мл молока и помещают в водяную баню при температуре 95...100 °С на 20 мин, охлаждают до комнатной температуры, добавляют воды до 2/3 объема и осаждают казеин путем добавления 1...1,5 мл 10%-ного раствора уксусной кислоты и 1 мл 1 н. раствора ацетата натрия (рН смеси 4,6...4,7). Содержимое колбочки перемешивают и доводят объем до метки водой, снова перемешивают и оставляют в покое на 10...15 мин. Затем смесь фильтруют через бумажный обеззоленный (складчатый и предварительно подкисленный) фильтр. Далее в две стеклянные пробирки вместимостью 20 мл отмеривают по 5 мл фильтрата и в одну пробирку – 5 мл 30%-ного раствора ТХК (для суспензии I), а в другую – 5 мл насыщенного раствора аммония сульфата (для суспензии II). Полученные смеси перемешивают и оставляют в покое на 10...15 мин для полного осаждения протеозо-пептонной фракции. Полученные суспензии I и II нефелометрируют на фотоэлектроколориметре при 360 нм (по оптической плотности определяют степень мутности суспензий). Величина оптической плотности суспензии I ДI соответствует суммарному количеству протеоз и пептонов, а величина оптической плотности суспензии II ДII соответствует протеозам. По разнице величин ДI и ДII определяют величину оптической плотности, соответствующей пептонам. Активность протеолитических ферментов выражают условно величиной оптической плотности в процентах по отношению к контролю (Шидловская В. П., Рашкина Н. А.).
Используются также методы электрофореза, хроматографии, позволяющие точно объяснить воздействие протеиназ на отдельные фракции казеина и провести четкое различие между нативными и бактериальными протеиназами. Преимуществом методов электрофореза является использование естественных субстратов. Вместе с тем, эти методы трудоемки и занимают много времени и поэтому используются в научно-исследовательских работах.
Выбор того или иного метода для определения протеолитической активности молока зависит от цели анализа и оснащенности лабораторий аппаратурой и реактивами.
Определение активности β-глюкуронидазы. Сущность метода. Визуальное фиксирование степени желтого окрашивания смеси молока с n-нитрофенил-β-D-глюкуронидом в результате образования n-нитрофенола.
Аппаратура, материалы, реактивы. Термостат с температурой нагрева 37 °С; пипетки градуированные вместимостью 1 мл; дозатор вместимостью 100 мкл; колба стеклянная плоскодонная вместимостью 150 мл; цилиндр стеклянный вместимостью 100 мл; и n-нитрофенил-β-D-глюкуронид (n-НФГ); Тритон Х-100; NaOH – 0,1 н. раствор; натрия ацетат буфер (рН 5,0), 0,05 М.
Ход определения. В стеклянную плоскодонную колбу вместимостью 150 мл отмеривают 0,8 мл цельного молока, 0,2 мл n-НФГ (31,5мг n-НФГ и 100 мкг Тритона Х-100 растворяют в 100 мл 0,05 М натрия ацетат-буфере, рН 5,0). Колбу помещают в термостат и выдерживают при 37 °С в течение 18 ч. Для остановки реакции в колбу добавляют 1 мл 0,1 н. раствора NaOH. Визуально фиксируют интенсивность желтого окрашивания n-нитрофенола. Положительную реакцию классифицируют от + до +++ (Perdigon G., Medici М. et al., 1985).
Определение активности АТФ-азы. Сущность метода. Для определения активности АТФ-азы в качестве субстрата используют АТФ, добавляемой к молоку в соотношении 1:1 (по 0,1 мл). При гидролизе АТФ образуется фосфорная кислота, поэтому активность фермента выражают увеличением количества миллиграмм неорганического фосфора в 100 мл молока в течение определенного промежутка времени при 37 °С (Рязанский М. П.).