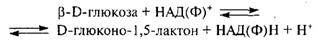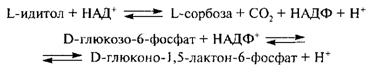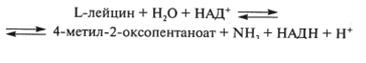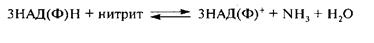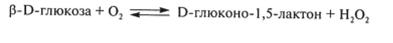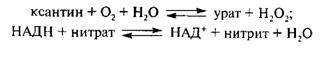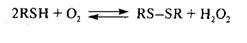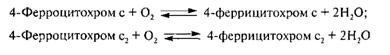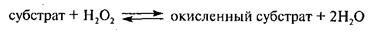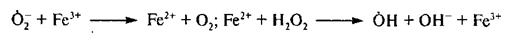Оксидоредуктазы катализируют окислительно-восстановительные реакции, осуществляя перенос водорода или электронов. При действии этих ферментов субстрат, подвергшийся окислению, рассматривается как источник (донор) водорода или электронов, а в качестве их приемника (акцептора) служат различные коферменты. Из оксидоредуктаз в молоке обнаружены некоторые дегидрогеназы, оксидазы, каталаза, лактопероксидаза, оксигеназы и др. – всего около 30 ферментов.
Дегидрогеназы. Дегидрогеназы по происхождению бывают нативными – компоненты различных клеток молочной железы, и микробными, которые в большом количестве могут накапливаться в сыром молоке при жизнедеятельности микроорганизмов (аэробных и анаэробных). Дегидрогеназы катализируют отщепление водорода (дегидрирование) от субстрата. Дегидрогеназы, обнаруженные в молоке, катализируют реакции окисления спиртов, окисления и окислительного декарбоксилирования органических кислот, окислительного дезаминирования аминокислот, восстановления нитратов и др.
Алкогольдегидрогеназа (1.1.1.1)[1] является в основном ферментом микробного происхождения. Например, дрожжевая алкогольдегидрогеназа представляет собой тетрамер с молекулярной массой 145 000 Да, каждая полипептидная цепь которого связывает НАД+ и ион цинка (поддерживает активность и структуру фермента). Фермент имеет изоформы. Для дрожжевой лактатдегидрогеназы характерна Км = 1,3 · 10-2 моль/л при активности 60 Е/мл анализируемого раствора, что соответствует активности ≈1,0 нкат. Алкогольдегидрогеназа, действуя на СН–ОН-группу субстратов и используя в качестве акцептора водорода кофермент НАД+, катализирует окисление спиртов до альдегидов или кетонов:
![]()
Ингибиторами фермента являются вещества, содержащие цинк.
Оптимальными условиями для действия фермента являются температура 37...40°С и рН 6,0...7,2. Образующиеся в результате окисления спиртов альдегиды и кетоны придают молоку различные пороки запаха и вкуса.
L-Лактатдегидрогеназа (1.1.1.27) имеет как нативное (возможный источник –цитоплазма секреторных клеток молочной железы), так и микробное происхождение.
Например, молочнокислые бактерии и среди них лактококки, являясь основной микрофлорой сырого молока, обладают достаточно выраженной лактатдегидрогеназной активностью. Часть фермента находится в ОШЖ молока. Фермент представляет собой тетрамер с молекулярной массой 140 000 Да и имеет пять изоформ.
В молоке обнаруживаются от 2 до 5 изоформ лактатдегидрогеназы, которые имеются в секреторных клетках молочной железы. Эти изоферменты состоят из двух видов полипептидных цепей М и Н, располагающихся в пяти комбинациях: 1 – Н4, 2 – Н3М, 3 – Н2М2, 4 – НМ3 и 5 – М4, однако преобладает из них комбинация 1, которая составляет 93 %, и 7 % комбинация 2. Наличие изоформ у микробной лактатдегидрогеназы связывают со способностью клеток микроорганизмов приспосабливаться к той или иной среде и, в частности, к развитию в молоке. Такая способность обнаружена у некоторых видов психротрофильных микроорганизмов с наиболее выраженной активностью при pH 6,0 и температуре 10...15 °C (Kitchen В. J., 1981).
Лактатдегидрогеназа действует на ту же группу субстрата и использует тот же акцептор водорода, что и алкогольдегидрогеназа. Оба фермента структурно родственны, высоко стереоспецифичны, и реакции, катализируемые ими, легкообратимы.
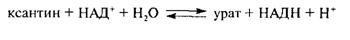
Основной реакцией, катализируемой лактатдегидрогеназой, является окисление L-молочной кислоты в пировиноградную кислоту:
Оптимальными величинами pH и температуры для этого фермента являются соответственно 6,0...7,2 и 37...40°С. Активность этого фермента в молоке составляет в среднем от 0,07 до 0,28 Е/мл (1,17...4,70 нкат (по Grün Е., 1985). Колебания активности фермента зависят в значительной степени от содержания в молоке соматических клеток (см. п. 2.2) и бактериальной обсемененности молока. Проявление активности лактатдегидрогеназы в молоке вызывает ухудшение его органолептических показателей.
Малатдегидрогеназа (1.1.1.38) – одним из возможных источников попадания этого фермента в молоко является (как и в случае лактатдегидрогеназы) цитоплазма секреторных клеток молочной железы. Этот фермент представляет собой димер с молекулярной массой ≈ 70 000 Да и катализирует окисление яблочной кислоты в пировиноградную:
Этот фермент имеет 2 изоформы – S НАД- и М НАДФ-зависимые, при этом S-форма является доминирующей в молоке и обладает большей активностью. Активность фермента в молоке составляет 0,04 Е/мл (≈0,67 нкат) (Jennes R., Walstra Р., 1984).
Некоторые бактерии группы кишечной палочки и стафилококков, бактерии родов Pseudomonas и Вас. cereus продуцируют глюкозодегидрогеназу (1.1.1.47), поэтому наличие этого фермента в молоке реально.
Этот фермент окисляет глюкозу с образованием D-глюконолактоновой кислоты:
Малат- и глюкозодегидрогеназы, также как и алкоголь- и лактатдегидрогеназы, действуют на СН–ОН-группу субстрата.
Имеются отдельные публикации о наличии в молоке сорбитдегидрогеназы (1.1.1.14) с концентрацией 0,17 мкмоль/мл и глюкозо-6-фосфатдегидрогеназы (1.1.1.49), катализирующие, соответственно, следующие реакции:
Происхождение, местонахождение, каталитические характеристики и роль их в молоке изучены крайне недостаточно (Grün Е., 1985).
Пируватдегидрогеназа (1.2.4.1) имеет нативное и микробное (бактерии рода Pseudomonas и группы кишечной палочки являются значительными продуцентами этого фермента, в то время как молочно-кислые кокки и энтерококки малоактивны в этом отношении) происхождение и представляет собой полиферментный комплекс, состоящий из нескольких ферментов: 8 молекул дигидролипоамиддегидрогеназы (1.8.1.4), 64 субъединиц дигидролипоацетилтрансферазы (2.3.1.12), объединенные в 4 агрегата, и 16 молекул пируватдекарбоксилазы (4.1.1.1).
Из Е. coli, например, выделена пируватдегидрогеназа с молекулярной массой около 4,8 · 106 Да. На основании электронно-микроскопического, физико-химического и биохимического исследований построена модель этого фермента (рис. 6).
Пируватдегидрогеназа катализирует окислительное декарбоксилирование пировиноградной кислоты, действуя на альдегидную группу субстрата при использовании в качестве акцептора водорода дисульфидного соединения:
В результате проявления активности пируватдегидрогеназы в молоке накапливаются химические соединения, придающие ему несвойственные запах и вкус, например окисленные.
Рис. 6. Модель полиферментного комплекса пируватдегидрогеназы из Е. coli (по В. Л. Кретович):
1 – 16 молекул пируватдекарбоксилазы; 2 – 8 молекул дигидролипоамиддегидрогеназы; 3 – дегидролипоацетилтрансфераза, состоящая из 64 субъединиц, объединенных в 4 агрегата
Сукцинатдегидрогеназа (1.3.99.1), как и малатдегидрогеназа, является малоизученным ферментом молока с неясной природой происхождения. Считают, что она имеет как нативное (митохондрии секреторных клеток молочной железы), так и микробное происхождение. Фермент является флавопротеином, состоящим из четырех субъединиц с молекулярными массами ≈ 70 000, 30 000, 14 000 и 12 000 Да, содержит ФАД (в качестве простетической группы) и имеет железо-серный центр. Сукцинатдегидрогеназа действует на СН–СН-группу, используя другой акцептор водорода, свойственный этому подклассу, и катализирует окисление янтарной кислоты в фумаровую кислоту:
Конкурентными ингибиторами фермента являются малоновая и щавелевоуксусная кислоты. В противоположность алкогольдегидрогеназы, этот фермент не ингибируется специфическим реактивом на его металл. Ингибиторами являются также ртутьсодержащие соединения, некоторые эфиры карбоновых кислот.
Причиной появления в молоке солодового привкуса и хлевного запаха может быть проявление активности микробных дегидрогеназ аминокислот. Например, лейциндегидрогеназу (1.4.1.9) активно продуцируют L. lactis, некоторые стафилококки и Вас. cereus. Лейциндегидрогеназа катализирует дезаминирование лейцина, действуя на СН-NН2-группу:
Фермент действует также на изо- и норлейцины, валин и норвалин.
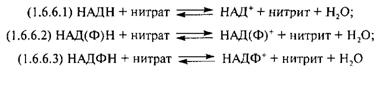
Нитратредуктазы (1.6.6.1; 1.6.6.2; 1.6.6.3) молока имеют микробное происхождение. Эти ферменты активно продуцируют различные грамотрицательные микроорганизмы, например флюоресцирующие, большинство стрептомицетов, микрококки и бактерии группы кишечной палочки. Молочнокислые бактерии обладают слабой нитратредуктазной активностью.
Эти ферменты представляют собой высокомолекулярные флавопротеины, содержат ФАД или ФМН, металлы (молибден – 1.6.6.3) и катализируют процесс восстановления нитрата в нитрит, используя в качестве акцептора водорода азотную группу:
В результате проявления активности нитратредуктаз в молоке могут накапливаться токсичные нитриты, являющиеся предшественниками образования канцерогенных нитрозаминов. И только возможное наличие и проявление в молоке активности нитритредуктазы (1.6.6.4) будут способствовать утилизированию нитритов до аммиака:
НАДН-дегидрогеназа (1.6.99.3) (цитохром с-редуктаза) происходит из эндоплазменного ретикулума секреторных клеток молочной железы, а также имеет микробное происхождение. Фермент содержит ФАД, имеет железо-серный центр и катализирует перенос водорода от НАДН на гемопротеин цитохромов. НАДН-дегидрогеназа, подобно нативной дигидролипоамиддегидрогеназе, связана с ОШЖ и имеет аналогичные оптимальные рН и температуру.
Обнаруженная в молоке дигидролипоамиддегидрогеназе (НАД+) (диафораза) (1.8.1.4) содержит ФАД, железо и катализирует окислительное декарбоксилирование α-кетокислот:
При этом акцептором водорода является дисульфидное соединение. Активатором фермента является молибден. Фермент является составляющим комплекса пируватдегидрогеназы (рис. 6). Полагают, что фермент имеет нативное (связан с ОШЖ) и микробное происхождение. Дигидролипоамиддегидрогеназа (НАД+) обнаружена и в обезжиренной фракции молока. Оптимальными величинами рН и температуры являются 7,3 и 18 °С соответственно Проявление активности этого фермента является одной из причин появления в молоке окисленного вкуса. Первые сообщения о флавопротеинах – НАДН-дегидрогеназе и дигидролипоамиддегидрогеназе (НАД+) молока появились в 1954 г.
На рис. 7 приведены микрофотографии некоторых кристаллических форм дегидрогеназ.
Рис. 7. Кристаллические формы некоторых дегидрогеназ (по Диксон М., Уэбб Э., 1982):
а – лактатдегидрогеназы, х420; б – Глюкозо-6-фосфатдегидрогеназа, молочная железа коровы, х370; в – пируватдегидрогеназа, Е. coli, х250; г – нитратредуктаза НАД(Ф)Н, Neurospora crassa, х950
Оксидазы. К оксидазам относятся ферменты, которые действуют на различные группы химических соединений, и при этом акцептором водорода является кислород. В молоке из оксидаз обнаружены глюкозооксидаза, ксантиноксидаза, аминоксидаза, аскорбатоксидаза, цитохром оксидазы и сульфгидрилоксидаза, как нативного, так и микробного происхождения. Активными продуцентами оксидаз аэробных грамотрицательных микроорганизмов являются психрофильные Pseudomonas, Aeromonas, Flavobacterium и Alcaligenes, а из грамположительных – Micrococcus (Otte J., 1982; Kroll R. G., 1989).
Глюкозооксидаза (1.1.3.4) является флавиновым ферментом микробного происхождения, содержит две молекулы ФАД (в качестве простатической группы) и действует на СН–ОН-группу глюкозы, катализируя ее окисление:
D-Глюконо-1,5-лактон с участием воды превращается в глюконовую кислоту. Глюкозооксидаза высокоспецифичный фермент в отношении β-D-глюкозы и устойчива к действию химических ингибиторов. Оптимальными условиями действия фермента являются рН 5...6 и 30 °С (Fox Р. Е, 1980).
Глюкозооксидаза получена в кристаллической форме, и молекулярная масса ее составляет 186 000 Да. Этот фермент, являясь наряду с глюкозодегидрогеназой (1.1.1.47) источником образования глюконовой и глюконолактоновой кислот, способствует повышению кислотности молока.
Ксантиноксидаза (1.1.3.22) – наиболее изученная из оксидаз молока (Ананиади Л. И. и др., 1983; Deeth Н. С, 1983 и др.). Это нативный фермент, первое сообщение о котором появилось около 100 лет назад. Возможным источником его попадания в молоко считают эндоплазматический ретикулум секреторных клеток молочной железы.
Ксантиноксидаза находится в основном в ОШЖ молока (на их внутренней стороне), составляя более 8...10% общего количества оболочечного белка (рис. 8). Содержание этого фермента в ОШЖ достигает 80 % от общего количества его в молоке. Фермент находится в молоке и в свободном виде (Brilay М. S., Eisenthal R.; по Grün Е., 1985).
Рис. 8. Модель сегмента оболочки шариков жира в сыром молоке (по Mcpherson A. W., Kitchen В. J., 1983):
1 – углеводные боковые цепочки; 2 – 5'-нуклеотидаза; 3 – гликопротеины; 4 – ксантиноксидаза; 5 – фосфолипиды, холестерин, триглицериды (основная масса оболочки); 6 – полипептид; 7 – высокоплавкие триглицериды
Имеются результаты многочисленных исследований по способам выделения ксантиноксидазы из коровьего молока и очистки ее до гомогенного состояния (Наглер Л. Г., Вартанян Л. С, 1976; Маngina М. Е., Brunner J. М., 1977; Nakamura М., Yamazaki J., 1982; Ананиади Л. И. и др., 1983; Zikakis J. R, 1984; Ortin A., Lopez-Perez М. J. et al., 1991; Olsen К., Kristensen D. et al., 2004) и, в частности, способу получения ксантиноксидазы в кристаллической форме впервые около 50 лет назад (рис. 9). В коровьем молоке содержится довольно значительное количество ксантиноксидазы 3,5...16 мг% – этот разброс объясняется различной степенью очистки фермента (Jennes R., Walstra P., 1984; Cheng S. G., Koch U., Brunner J. R., 1988).
Рис. 9. Кристаллические формы некоторых оксидаз и лактопероксидаз (по Диксон М., Уэбб Э., 1982; а – Ito О., Akuzawa R., 1983):
а – ксантиноксидаза, коровье молоко, х1000; б – цитохромоксидаза, Pseudomonas aeruginosa, х160; в – каталаза, коровье молоко, х400; г – каталаза. Micrococcus lysodeikticus, х200; д – пероксидаза, коровье молоко, х700; е – аминоксидаза (содержащая медь), Aspergillus niger, х700
Ксантиноксидаза – это флавопротеин и представляет собой димер с высокой молекулярной массой – 275 000...300 000 Да, состоящий из двух субъединиц с одинаковой молекулярной массой. Определена четвертичная структура фермента, выделенного из молока. Ксантиноксидаза содержит ФАД, железо и молибден, соотношение которых в молекуле фермента составляет: ФАД (моль): железо (атом): молибден (атом) = 2:8:2. По сообщениям В. В. Ковальского, Г. Г. Цой, И. Е. Воротницкой, ксантиноксидаза может содержать и медь – до ≈ 2 атомов на одну молекулу фермента и молибден – 0,43...0,30 мкг/мг белка. Каждая субъединица фермента имеет независимый активный центр, содержащий 1 моль ФАД, 4 атома железа и 1 атом молибдена. При этом молибден связан с пептидом, а железо – с серой.
В состав молекулы фермента входят 1480 различных аминокислот. Аминокислотный состав ксантиноксидазы, выделенной из ОШЖ молока, достаточно близок к аминокислотному составу белков этих оболочек (табл. 1) (Mangina М. Е., Brunner J. R, 1977).
Таблица 1
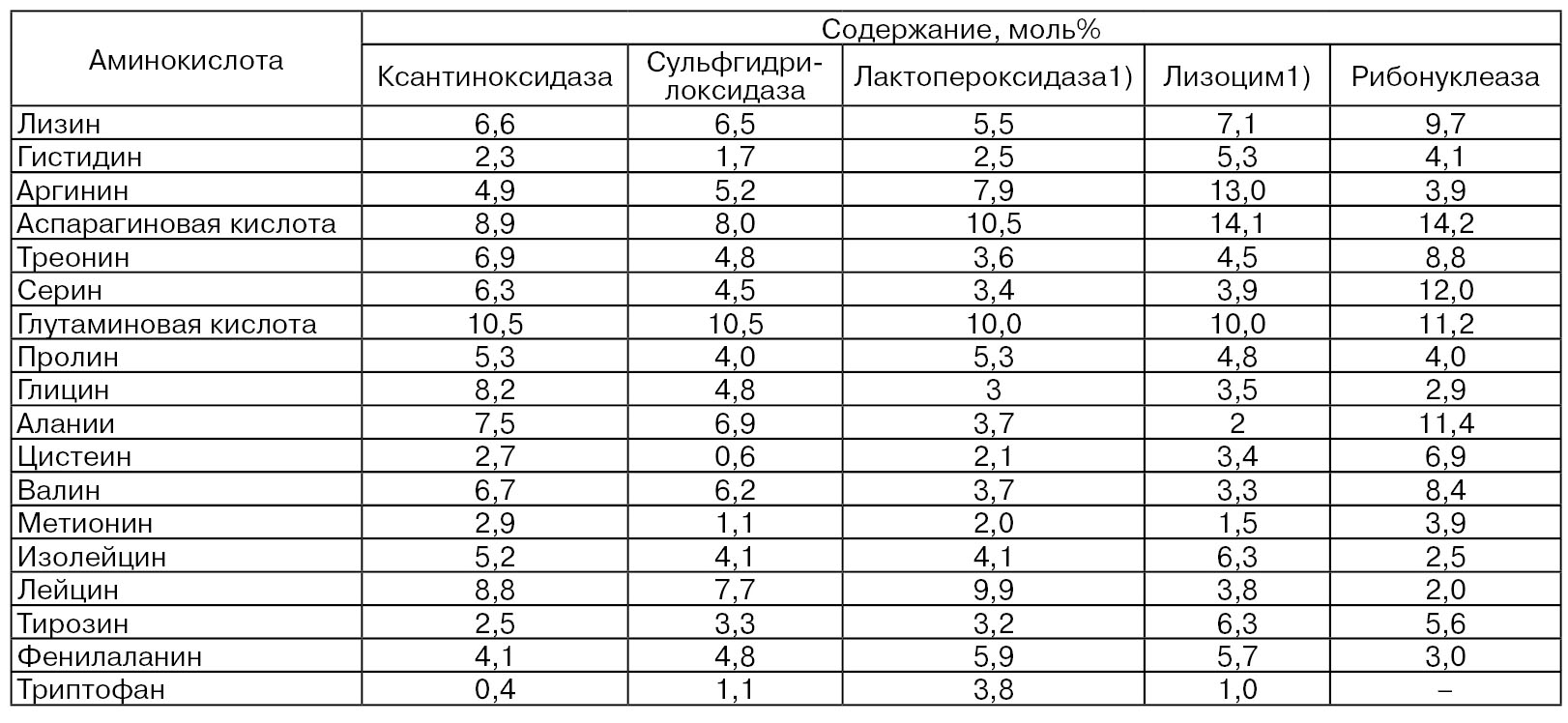
1) Аминокислотный состав лактопероксидазы и лизоцима пересчитан на моль% автором.
Изоэлектрическая точка фермента находится при рН ≈ 6,0 (по некоторым исследованиям – 5,3...5,4).
Ксантиноксидаза молока имеет 6 изоформ, заметно различающихся по электрофоретической подвижности (от 0,025 до 0,400). Преобладающей из них является изоформа 2, содержание которой достигает ≈ 90 % общего количества фермента в молоке. Ее электрофоретическая подвижность составляет 0,337, удельная активность – 5,0...5,4 усл. ед.[2] на 1 мг белка.
Ксантиноксидаза катализирует окисление большого числа соединений молекулярным кислородом: ксантин и гипоксантин, некоторые другие пурины, пиримидины и птерины, а также альдегиды (до соответствующих карбоновых кислот), т. е. она довольно неспецифична.
При окислении ксантиноксидазой субстрата акцептором водорода служит не только кислород, но и окислительно-восстановительные индикаторы. Так, при добавлении к молоку какого-либо субстрата для фермента, метиленового голубого или резазурина, ксантиноксидаза, окисляя субстрат, одновременно восстанавливает индикаторы, которые меняют свою окраску, что используется при определении активности этого фермента (см. с. 240).
Показано, что концентрация ксантиноксидазы не определяет степень восстановления резазурина, играет роль вид субстрата или его предшественника. Так, если при субстрате гипоксантина или формальдегида восстановление резазурина проходило за 1...2 мин, то при субстрате аденина или инозина – за 7...8 мин (условия реакции – 5 мл молока и 0,5 мл стандартного раствора резазурина) при 37°С. Пастеризация молока также не влияла на степень восстановления резазурина (Campbell J. R., Keur L. В.).
- H. Бах в конце XIX в. обнаружил, что ксантиноксидаза обладает способностью использовать нитраты в качестве акцепторов водорода в анаэробных условиях. Установлено, что при изменении рН среды у ксантиноксидазы меняется направленность реакций: при щелочных рН фермент действует как ксантиноксидаза, т. е. окисляет ксантин, альдегиды и др.; при кислых рН в анаэробных условиях фермент действует как нитратредуктаза (1.6.6.1), т. е. восстанавливает нитраты:
Результаты работ З. А. Аликулова, Н. П. Львова, В. Л. Кретовича (1980) показывают, что ксантиноксидаза проявляет и нитритредуктазную активность. Оптимум рН для проявления нитратредуктазной активности ксантиноксидазы составляет ≈ 5,2 (для нитритредуктазной активности – 5...6), а для ксантиноксидазной активности – 9,6 (Nakamura M.., Yamazaki J.., 1982; Сергеев Н. С. и др., 1983). Результаты работ этих же исследователей показали, что ксантиноксидаза имеет 2 активных центра: молибденовый – на котором происходит связывание и окисление субстрата (или восстановление) и железо-серный – на котором происходит восстановление нитритов. Этот полиморфизм ксантиноксидазы зависит от генетических факторов и кормления.
Фермент достаточно высокоактивен при 25...40°С. Проявление ксантиноксидазной или нитрат-нитритдегидрогеназной активностей фермента, происходящее при изменении рН, является следствием значительных конформационных изменений в молекуле фермента (Ананиади Л. И., 1983; Сергеев Н. С, Кильдибеков Н. А. и др., 1983).
Установлено, что ксантиноксидаза находится в свежевыдоенном молоке в основном как смесь дегидрогеназной (D-форма) и оксидазной (О-форма) форм, которые переходят друг в друга (табл. 2).
Таблица 2
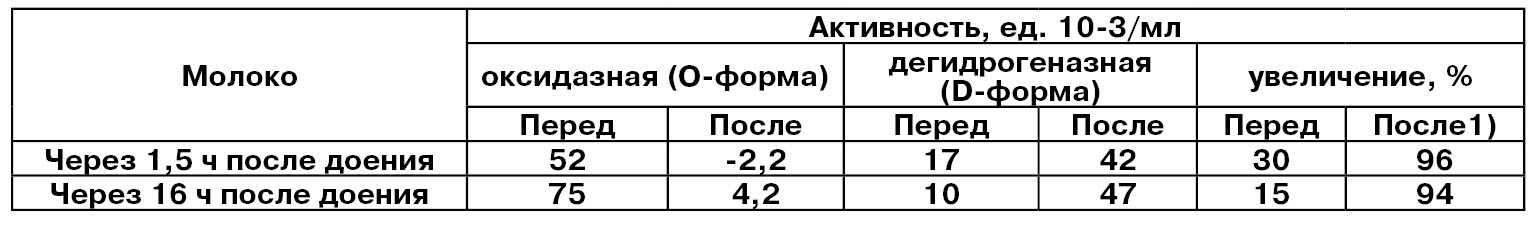
1)Активность фермента измеряли перед и после инкубации образца молока с 10 ммоль дитиоэритритолом при 37 °С в течение 10 мин. Затем дитиоэритритол удаляли гелевой фильтрацией (Nakamura M.., Yamazaki J., 1982).
Из табл. 2 видно, что дегидрогеназная активность ксантиноксидазы в свежем молоке довольно заметная и при хранении молока в течение ночи она снизилась на 7 ед., в то время как оксидазная активность заметно повысилась, В свежем молоке после инкубации с дитиоэритритолом фермент почти полностью конвертировался в D-форму.
Переход D-формы в О-форму и обратно, по-видимому, связан с пептидным фрагментом молекулы фермента, на котором локализирован ряд SН-групп, окислительно-восстановительное состояние которых определяет ту или иную форму фермента. При переходе фермента из О-формы в D-форму повышается и его нитратредуктазная активность. Повышение ксантиноксидазной и нитратредуктазной активностей фермента обусловлено, возможно, обнажением Мо-центра, на котором происходят связывание и восстановление субстратов. При этом играют роль и другие конформационные превращения молекулы фермента. Важно подчеркнуть, что наибольшей нитратредуктазной активностью обладает D-форма ксантиноксидазы. Ксантиноксидаза, подвергшаяся частичному гидролизу протеазами молока, теряет способность к превращению в ксантиндегидрогеназу. В молоке ксантиноксидаза находится и в неактивной форме, например, если ее молекула лишена молибдена или сульфида.
Ксантиноксидаза в форме ксантиндегидрогеназы (1.1.1.204) катализирует следующую реакцию:
Таким образом, в молоке ксантиноксидаза проявляет себя непосредственно как ксантиноксидаза, нитрат- и нитритредуктаза и ксантиндегидрогеназа (≈ 30 %), что указывает на полифункциональные свойства этого фермента (Сергеев Н. С, Ананиади Л. И. и др., 1983).
Каталитическая активность ксантиноксидазы молока в зависимости от ее местоположения несколько различна. Активность к ксантину у связанной ксантиноксидазы более выражена у фермента, выделенного из пахты, по сравнению с ферментом, выделенным из обезжиренного молока. Так, ксантиноксидазная активность связанного фермента, полученного из пахты и обезжиренного молока, составила соответственно 42 и ≈ 23 % и свободного фермента – ≈ 47 и 59% общей активности фермента. Это объясняется тем, что при производстве масла в пахту переходит почти весь оболочечный материал шариков жира сливок, в то время как при производстве сливок из молока в обезжиренное молоко переходит значительно меньшее количество оболочечного материала, а следовательно, и ксантиноксидазы.
В литературе имеются многочисленные данные по активности ксантиноксидазы в сыром коровьем молоке, однако в связи с тем, что при этом авторами были использованы различные методы определения, величины этой активности неодинаковы:
- по продолжительности обесцвечивания метиленового голубого 39...105 с;
- в мВ/мин – 20...30;
- в международных единицах Е/мл – в среднем от 0,11 до 0,21 (≈ 1,8…3,5 нкат) (по Grün Е., 1985);
- в мкл О2/мл/ч – от 30 до 140 (или 175 мкмоль О2/мин/л).
Удельная активность фермента составляет 5 мкмоль/мин/мг (Jennes R., Walstra P., 1984).
Имеется целый ряд органических и неорганических соединений, служащих активаторами (например, гистидин) или ингибиторами фермента (например, соли тяжелых металлов, Н2О2) (Ананиади Л. И., Сергеев Н. С, Кильдибеков H.A., 1983). Ингибитором ксантиноксидазы является также фолиевая кислота, при концентрации 0,63 мг% она наиболее эффективна и особенно при субстрате – гипоксантина. Стабилизирующее действие на нитратредуктазную активность ксантиноксидазы оказывает добавление натрия салицилата, молибдена и аскорбата.
Следует отметить, что активность ксантиноксидазы в свежевыдоенном неохлажденном молоке не характеризует ее общую активность, так как большая часть фермента связана с ОШЖ, и его каталитическое действие ограничено. Поэтому ксантиноксидаза является одним из ферментов молока, содержание и активность которого в водной фазе повышается при различных тепловых, механических и других воздействиях на молоко (гл. 2, 3).
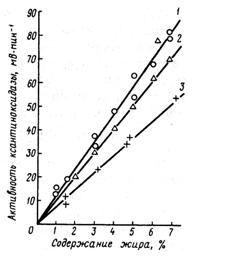
Установлена достаточно выраженная зависимость между содержанием в молоке жира и активностью в нем ксантиноксидазы (рис. 10) (в маститном молоке такой зависимости не наблюдается) (Back W. D., Reuter Н.). В то же время, хотя ксантиноксидаза участвует в белковом обмене животного организма, выраженной зависимости между активностью этого фермента в молоке и содержанием в нем белка не установлено. Вместе с тем ксантиноксидаза, катализируя окислительно-восстановительные реакции и, в частности, окисление многих альдегидов до кислот, участвует в той или иной степени в появлении окисленного вкуса в молоке. Показано, что ксантиноксидаза, находясь в ОШЖ, может принять участие в окислении фосфолипидов, содержащих ненасыщенные жирные кислоты. Особенно этот процесс усиливается при загрязнении молока медью в результате соприкосновения с металлическими частями оборудования, содержащими медь. Таким образом, ксантиноксидаза может быть причиной ухудшения органолептических показателей молока.
Рис. 10. Активность ксантиноксидазы в сыром молоке, полученном от различных коров (1, 2, 3)
Учитывая значительную концентрацию ксантиноксидазы в молоке и ее активность, а также способность фермента проявлять нитрат- и нитритредуктазные активности, этот фермент может участвовать в процессе утилизирования нитратов и нитритов, являющихся предшественниками канцерогенных для организмов нитрозаминов.
Ксантиноксидаза выполняет в молоке важную биологическую функцию, являясь естественным источником перекиси водорода, которая является недостающим компонентом для антибактериальной системы молока, включающей лактопероксидазу, перекись водорода и тиоционат. Бактериальный эффект ксантиноксидазы обнаружен в молоке при снижении его рН с 6,7 до 5,0:
|
pH молока, содержащего 0,25 мМ тиоционата и 0,01 мМ гипоксантина |
6,7 |
6,0 |
5,5 |
5,0 |
|
КОЕ Е. coli/мл при 37 °С после 2 ч инкубирования[3] |
5 ·106 |
7·105 |
1,4·104 |
7·103 |
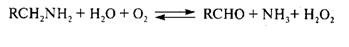
Аминоксидаза (1.4.3.6), как считают, является нативным ферментом и попадает в молоко из плазмы крови. Имеются данные и об аминоксидазе микробного происхождения (Asp. niger), которая получена в кристаллической форме (рис. 9). Местоположение его в молоке неизвестно. Этот медьсодержащий фермент, действуя на СН–NH2-rpynny субстрата, катализирует окислительное дезаминирование первичных моно- и диаминов, включая гистамин:
Образующиеся в результате ферментативной реакции альдегиды и аммиак ухудшают вкус и запах молока.
Сульфгидрилоксидаза (1.8...) является нативным ферментом, первое сообщение о котором появилось в 1967 г. Около 23 % фермента связано с ОШЖ, но большая часть его находится в глобулиновой фракции – около 55 %, а также связано с казеином – около 21 %. Считают, что это количественное распределение фермента связано с γ-глутамилтрансферазой (2.3.2.2), поскольку предполагают, что проявление двух активностей свойственно одной и той же молекуле фермента (McPherson А. V., Kitchen В. J., 1983; по Grün Е., 1985).
Значительные исследования в части выделения, очистки и характеристики сульфгидрилоксидазы молока проведены разными авторами (Kiemeier F., Ranfft K., Janolino V.G., Morrison-Rowe S.J., 1990).
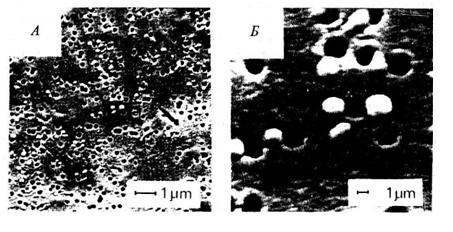
По внешнему виду сульфгидрилоксидаза представляет собой неровную сферической формы частицу размером от 200 до 300 нм (рис. 11). Эта высокоагрегированная белковая молекула гликометаллопротеина состоит из нескольких субъединиц. Средняя молекулярная масса одной субъединицы составляет (89 000 ± 900) Да. Молекула фермента состоит из 89 % аминокислот и 11 % карбогидратов. При этом в состав карбогидратов входят: фукоза – 0,44 %, общие гексозы – 7,19, N-ацетилгексозамин – 2,90 и N-ацетилнейраминовая кислота – 41 %. В состав субъединицы фермента входят около 0,5 г · атом железа и 0,15 г · атом меди, следы кобальта и цинка.
Рис. 11. Микрофотография сульфгидрилоксидазы молока (Janolino V.G. еt аl., 1980):
А - х 10000; Б - х50000
В табл. 1, с. 29 приведены данные по аминокислотному составу сульфгидрилоксидазы. В состав молекулы фермента входят 720 аминокислот. Удельная активность препарата фермента составляет более чем 50 мкмоль/мин/мг (Jennes R., Walstra Р., 1984). Сульфгидрилоксидаза, действуя как аэробная оксидаза, катализирует окисление сульфгидрильных групп в L-, D-цистеине, в восстановленном глутатионе и денатурированных белках в присутствии кислорода с образованием эквимолярных количеств дисульфида и перекиси водорода:
Оптимумы действия фермента составляют: pH 7,0 и температура 35 °С (отмечают и 45…50 °С). Фермент проявляет активность и при pH 4,5…9,0. Величина Км при использовании в качестве субстрата глутатиона равна 90 мкмоль. Субстратное ингибирование сульфгидрилоксидазы отмечается при концентрации глутатиона выше 0,8 ммоль. Активность сульфгидрилоксидазы в коровьем молоке, определяемая по изменению потенциала в результате окисления SH-групп, достигает 2 мВ/мин, а содержание ≈ 0,3 мг%.
Ингибиторами фермента являются аскорбиновая кислота (неконкурентный), семикарбазид и гуанид (конкурентные), а активатором – ФАД.
Физиологическая функция сульфгидрилоксидазы заключается в образовании дисульфидных связей при синтезе белков молока в молочной железе, а технологическая – в способности снижать степень выраженности перепастеризованного вкуса и запаха, или карамелизованных в молоке, подвергнутом высокотемпературной обработке, в результате окисления сульфгидрильных групп, образующихся при денатурации сывороточных белков (см. п. 3.1). Установлено, что сульфгидрилоксидаза участвует в конвертировании D-формы ксантиноксидазы в О-форму (по Kitchen В. J., 1985).
Цитохромоксидазы. Наиболее активными продуцентами цитохромоксидаз в молоке являются психрофильные бактерии рода Pseudomonas и некоторые другие грамотрицательные бактерии. Источниками цитохромоксидаз могут быть и секреторные клетки молочной железы.
К цитохромоксидазам относятся цитохром с-оксидаза (1.9.3.1) и цитохромоксидаза Pseudomonas (1.9.3.2), которая выделена и получена в кристаллической форме (рис. 9).
Эти ферменты представляют собой гемопротеины: соответственно цитохром типа «а», содержащий медь, и цитохром cd, и катализируют реакции окисления цитохромов и восстановления кислорода:
Для цитохромоксидазы Pseudomonas акцептором водорода могут служить и нитриты. Активность цитохромоксидаз рекомендовано использовать в качестве теста для оценки качества сырого молока по бактериальной обсемененности в части наличия Pseudomonas (например, Ps. aeruginosa и Ps. fluorescens), как самой многочисленной группы психрофильных бактерий, способных вызывать снижение качества молока при хранении в охлажденном состоянии. Молочнокислые бактерии не содержат цитохромов и поэтому не обладают цитохромоксидазной активностью.
Результаты анализа 500 образцов сырого молока (с использованием смеси 1%-ного водного раствора N,N-диметил-n-фенилендиамина с 1%-ным спиртовым раствором α-нафтола) при их термостатировании в течение 30 мин при 30 °С показали, что 50% образцов были отрицательно, 35 % – слабо и 15 % – отчетливо или сильно цитохромоксидазными. При этом количество цитохромоксидазоположительных колоний Pseudomonas, определенные чашечным методом, составило в среднем 50% от общего количества психрофильной микрофлоры, а в образцах с сильновыраженной активностью – 90%. Отмечают, что такой тест объективен при количестве психрофильной микрофлоры не более 104 КОЕ/мл. Для молока со значительной бактериальной обсемененностью (3 и 4 классы по редуктазной пробе) указанный тест не пригоден в связи с высокими восстановительными условиями. После предварительной выдержки молока при 20 °С в течение 18 ч тест пригоден и для пастеризованного молока (Kroll R. G., 1989, 1993).
Имеются незначительные сведения о содержании в молоке лакказы (полифенолоксидазы) (1.10.3.2) и в том числе о ее связи с ОШЖ. Этот медьсодержащий фермент действует на фенолы и родственные им соединения. Активность лакказы в коровьем молоке составляет в среднем (3,18 ± 1,07) Е/мл при 37°С (по Grün Е., 1985).
Причиной снижения содержания в молоке аскорбиновой кислоты может быть проявление активности L-аскорбатоксидазы (1.10.3.3) (аскорбазы). Фермент представляет собой медьсодержащий (до 0,25 %) протеин с молекулярной массой 150 000 Да. Полагают, что медь связана через SH-группы с белком.
Медь в ходе катализа меняет свою валентность. Реагенты, связывающие медь, подавляют действие фермента. L-аскорбатоксидаза катализирует окисление L-аскорбиновой кислоты в дегидроаскорбиновую кислоту:
Ингибиторами L-аскорбатоксидазы являются: гликокол; аспарагиновая и глутаминовая кислоты; цистеин; щавелевая, лимонная и винная кислоты; пектины, флаваноиды, дубильные вещества.
Происхождение и местоположение аскорбатоксидазы в молоке неизвестно.
Пероксидазы. К этим ферментам молока относятся каталаза и лактопероксидаза. Оба фермента используют перекись водорода в качестве акцептора водорода.
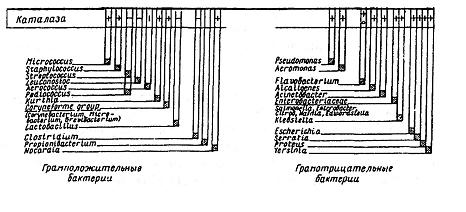
Каталаза (1.11.1.6) имеет различное происхождение и впервые обнаружена в молоке в 1907 г. Источником нативного фермента являются как цитоплазма и лизосомы секреторных клеток молочной железы, так как обнаружена в молоке, полученном в асептических условиях, так и лейкоциты. Фермент имеет и микробное происхождение. Каталаза обнаружена у всех видов аэробных микроорганизмов. При этом иногда ее количество достигает 1 % сухой массы бактерий. Психрофильные и гнилостные бактерии, стафилококки и уксуснокислые бактерии обладают хорошо выраженной каталазной активностью, в то время как молочнокислые бактерии в основном каталазоотрицательны. Например, активность каталазы Е. coli почти в 10 раз выше, чем L. lactis (Luck Н., 1991) (рис. 12).
Рис. 12. Микробные источники каталазы в молоке (Otte G., 1982):
«+» – 85...100% продуцируют фермент; «–» – 85...100% не продуцируют фермент; «0» – нет данных; «I» - слабая реакция
Нативная каталаза находится в молоке в различных формах. Она связана с оболочками шариков жира (20...30 % ее общего количества) и в меньшей степени с мицеллами казеина и сывороточными белками, а от 15 до 35 % находится в свободном состоянии. Установлено, что 80 % каталазы в ОШЖ молока может быть связано с липопротеинами.
Показано, что при центрифугировании сырого свежего молока (900 g) в течение 20 мин в сливочном слое (50% жира) обнаружено около 60 %, а в обезжиренном молоке – около 40 % каталазы. При этом, в сливках обнаружены 2 изоформы каталазы, активность которых составляла 19 и 81 % от общей активности фермента в сливках, а в обезжиренном молоке – одна изоформа. Кроме того, отмечено, что 10...30 % первой изоформы в сливках были подобны изоформе каталазы обезжиренного молока. Эти изоформы несколько отличаются одна от другой хроматографически и электрофоретической подвижностью. Установлено местонахождение каталазы в полученных сливках, а именно: 55,5 % в ОШЖ, 13,4% в казеине и 19,4% в глобулине и оболочках шариков жира, содержащихся в водной фазе сливок. В сливках активность каталазы была почти в 70 раз выше, чем в исходном молоке (Ito O., Akuzava R., 1983).
Разработаны способы выделения и очистки каталазы из молока с использованием различных видов хроматографии. В зависимости от способов и качества очистки, выход каталазы составляет от ≈ 500 до 700 мкг из 1 л молока. Каталаза получена в кристаллической форме (рис. 9). Для получения кристаллической каталазы вполне логично используют ту ее изоформу, которая составляет 81 % (по активности около 70 %) от общего ее содержания в сливках (содержание жира 50 %). При этом удельная ее активность в 23 600 раз превышала активность исходного молока – 300 и 0,0127 ед/г белка соответственно. Молекулярная масса полученной кристаллической каталазы составляла 225 000 Да (по другим данным – в пределах 225 000...250 000Да) и она была электрофоретически гомогенна (Ito O., Akuzava R., 1983; Ito O., Kamata S. et al., 1990).
Каталаза является гемопротеином, содержащим в активном центре 0,09% железа, что соответствует 4-м атомам на молекулу.
Каталаза катализирует окисление перекиси водорода:
Кроме того, каталаза может катализировать, но слабее, окисление перекисями некоторых органических соединений, как, например, ненасыщенные жирные кислоты, спирты, тем самым способствуя развитию в молоке окисленного вкуса. Следовательно, ее специфичность недостаточно высока, и в этом смысле каталазное расщепление перекиси водорода – это особый случай лактопероксидазной реакции.
Оптимальными условиями для действия каталазы являются температура 20...40°С при рН около 8,0 (6,0...9,0). При рН 5,0 и 10,0 остаточная активность фермента составляет 27 и 60% соответственно. Полная инактивация фермента происходит при pH 4,0. Изоточка каталазы отмечается при рН 5,5. Активность каталазы в коровьем молоке составляет в среднем ≈ 0,1...0,3 Е/мл (≈ 1,7...5 нкат). Имеются данные, что активность каталазы в молоке составляет 7,5...36,0 ед., при этом 1 ед. соответствует количеству фермента, вызывающего образование 1 мкмоль О2/мл молока/мин при 25 °С (Ito O., Akuzava R., 1983; Jennes R., Walstra P., 1984; пo Grün E., 1985).
Активность каталазы в нормальном молоке прямо пропорциональна содержанию в нем жира. Сывороточные белки стабилизируют активность фермента. Ингибиторами каталазы являются перекись водорода, некоторые органические и неорганические кислоты (например, молочная, уксусная, соляная, азотная), афлатоксины, соли тяжелых металлов, нитраты (по Kitchen В. J., 1985).
Лактопероксидаза (1.11.1.7) является первым ферментом, обнаруженным в молоке (1881). Установлено, что нативная лактопероксидаза является специфическим белком секреторных клеток молочной железы и выделяется в молоко вместе с другими секретируемыми белками (С. М. Попов, Слепенков С. В., Кокряков В. Н., 1981). Лактопероксидаза может иметь в молоке также лейкоцитное и бактериальное происхождение (кроме молочнокислых бактерий).
В молоке лактопероксидаза находится в свободном и связанном состоянии, в основном – с сывороточными белками, составляя ≈ 1 % их общего содержания в молоке (по Grün Е., 1985).
В литературе описано несколько способов выделения и очистки лактопероксидазы из молока (Kitchen В. J., 1985; Денисова А. И., Крашенюк А. И. и др., 1986; Hernander М. С. М., Markwijk В. W., Vreeman Н. J., 1990; Chiu С. К., Etrel М. R., 1997). Выделенная из молока лактопероксидаза получена в кристаллической форме (рис. 9). Удельная активность фермента довольно высока и составляет 230000 ед./мг белка. Содержание фермента в молоке непостоянно и зависит от периода лактации, времени года, кормления и породы коров (Глава 2., п. 2.1). Так, его содержание в молоке обычно составляет 1...6 мг% и может достигать 10 мг% (Тамим А. И., Робинсон Р. К., 2003).
По данным различных исследователей, в состав молекулы лактопероксидазы (гемогликопротеина) входят 15,6...15,9% азота, 0,069...0,073% железа, глюкозамин, галактозамин и 1,5...5,4% нейтральных сахаров. Белковая часть молекулы фермента состоит из 66...68 пептидов. Точной структуры молекулы фермента не установлено. Считают, что это димер, две субъединицы которого различаются содержанием сахаров. В молекулу фермента входят 613 аминокислот. Аминокислотный состав лактопероксидазы приведен в табл. 1, с. 29.
В каталитическом центре молекулы лактопероксидазы имеется небелковая группа, содержащая железо, которая ковалентно связана с одиночной полипептидной цепью через дисульфидные мостики. Ион кальция прочно связан с ферментом и стабилизирует его молекулярную структуру (Буруянэ Л. М., Георгиу А. С; Тихомирова Н. А., Комолова Г. С, Ионова И. И., 2004).
Молекулярная масса фермента составляет 76400...92700 Да, изоэлектрическая точка находится при рН 7,7...8,9. Фермент имеет 4 изоформы. Лактопероксидаза катализирует реакции окисления различных органических и неорганических соединений перекисью водорода, например фенолы, ароматические амины и кислоты, триптофан, йодид, тиоцианат, нитрит и др. Реакция окисления проходит следующим образом:
Литературные данные по активности лактопероксидазы заметно отличаются, и их трудно сравнивать из-за различия условий эксперимента и вида субстрата, используемого для измерения активности. Так, по одним данным, активность фермента в коровьем молоке составляет 2...13 ед. (1 ед. соответствует количеству фермента, вызывающего изменение оптической плотности смеси молока и n-фенилендиамина дигидрохлорида на 1 ед./мин при 490 нм и 20 °С). Активность лактопероксидазы в молоке составляет 3,6...5,5 Е/мл (≈ 60...92 нкат). По другим исследованиям, активность лактопероксидазы достигает 22 Е/мл (≈ 370 нкат) при 25°С (Jennes R., Walstra Р., 1984; по Grün Е., 1985).
Оптимальными условиями для действия лактопероксидазы являются температура 18...25 °С и pH 6,8. Однако фермент достаточно устойчив и к более низким температурам и pH, но при pH ниже 4 он теряет свою активность. Ингибиторами фермента служат хлороформ, формалин, фтор, высокие концентрации перекиси водорода (более 0,015 моль), а активатором – железо. Лактопероксидаза достаточно устойчива к действию протеолитических ферментов.
Многочисленными исследователями показано, что лактопероксидаза является одним из факторов антибактериальной системы молока, наряду с природными антимикробными пероксидазными системами в таких секрециях человека, как слюна и слеза.
Лактопероксидазо-антибактериальная система молока включает, кроме фермента, тиоцианат и перекись водорода и воздействует на довольно большую группу микроорганизмов. Например, эта система молока оказывает бактериостатическое действие на L. cremoris, термофильные молочнокислые палочки, маститные Str. agalactial, Str. uberis и бактерицидное действие – на маститные Stph. aureus и Е. coli; патогенные и энтеропатогенные S. typhosa, S. paratyphi, S. typhimurium, Ps. aeruginosa, Str. pyogenes; вызывающие порчу молока Ps. fluorescens (Björck L., 1982). Роль лактопероксидазы в этой системе состоит в катализировании окисления перекисью водорода тиоцианата (а также бромидов и иодидов). Среди промежуточных продуктов данного окисления оксикислоты тиоцианата вызывают изменения в оболочке бактериальных клеток. Это воздействие наиболее выражено по отношению к вегетативным клеткам и значительно меньше – к спорам (см. гл. 2).
Свободные SH-группы, содержащиеся в молоке, подвергнутом тепловой обработке, в большом количестве, подавляют антибактериальный эффект лактопероксидазы молока. Это происходит, возможно, по причине связывания их тиоцианатом или благодаря восстановлению ими гипотиоцианата. Однако в сыром молоке свободные SH-группы имеются в незначительном количестве.
Поскольку лактопероксидаза катализирует окисление различных органических соединений молока перекисью водорода, проявление ее активности может быть причиной появления в молоке различных пороков вкуса и запаха.
Оксигеназы. Эти ферменты отличаются от оксидаз тем, что катализируют включение кислорода в молекулу окисляемого субстрата с образованием двойной связи. По числу атомов кислорода, включаемых в реакцию, оксигеназы подразделяются на моно- и диоксигеназы.
Имеются сведения о наличии в молоке медьсодержащей монофенолмонооксигеназы (1.14.18.1) (тирозиназа). Ее происхождение и местонахождение, характеристики активности и роль в молоке изучены крайне недостаточно. В соответствии с номенклатурой ферментов, этот фермент действует на субстрат, катализируя включение одного атома кислорода:
Липоксигеназа (1.13.11.12) относится к диоксигеназам. В молоко этот фермент, видимо, попадает из секреторных клеток молочной железы, т. е. является нативным.
Липоксигеназа содержит железо и катализирует окисление полиненасыщенных жирных кислот, в результате чего образуются сильные окислители – гидроперекиси, которые, в свою очередь, могут окислять не только ненасыщенные жирные кислоты, но и каротиноиды, аскорбиновую кислоту и др.:
Лучшим субстратом для липоксигеназы, является линолевая кислота, которая окисляется до соответствующей гидроперекиси. При катализировании липоксигеназой окисления ненасыщенных жирных кислот гидроперекисями образуются различные альдегиды и кетоны, придающие молоку неприятные вкус и запах. Считают, что липоксигеназными свойствами обладают высокомолекулярные глобулины и цитохром с, содержащийся в оболочках шариков жира молока.
Выделенная из молока пероксид-дисмутаза (1.15.1.1) по своим свойствам идентична этому же ферменту, выделенному из эритроцитов крови, который имеет одну сульфидную связь и представляет собой нековалентно связанный димер с удельной активностью 3300 мкмоль/мин/мг. Установлено, что пероксид-дисмутаза, имеющая происхождение из эритроцитов крови, имеет 3 изоформы. Активными продуцентами фермента являются также факультативно анаэробные микроорганизмы (табл. 3). Первое сообщение о нахождении пероксид-дисмутазы в молоке появилось в 1975 т. (Hill R. D., Hicks С. L.). Пероксид-дисмутаза находится в обезжиренной фракции молока, и ее содержание составляет 15...240 мкг% (в крови около 4,0 мг%).
Пероксид-дисмутаза – это металлопротеин. Молекула фермента состоит из двух подобных полипептидов, каждый из которых содержит по атому цинка и меди/моль. Каждый полипептид имеет молекулярную массу ≈ 16000 Да. Считают, что в молоке имеется и марганецсодержащая нативная пероксид-дисмутаза, которая составляет лишь очень небольшую часть общего количества фермента и представляет собой тетрамер с молекулярной массой 80 000 Да. Молекула бактериальной (например, Е. coli) пероксид-дисмутазы содержит марганец и представляет собой димер, состоящий из двух подобных субъединиц с молекулярной массой 40000 Да (Hicks С. L, 1980; Jennes R.,Walstra P, 1984; Kitchen В. J., 1985).
Таблица 3
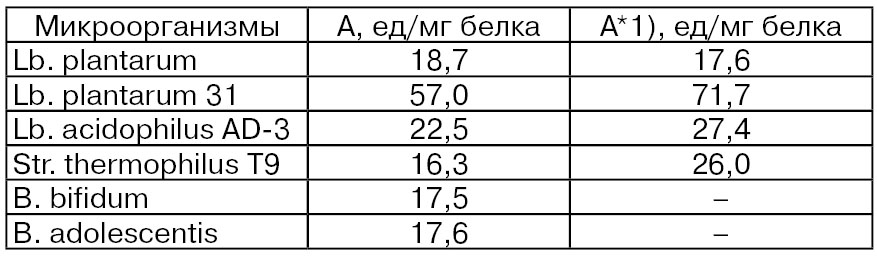
1)А* – активность пероксид-дисмутазы в бактериях, выросших на средах, содержащих 50 ммоль Мn2+. Активность (А) определяли спектрофотометрически при 560 нм по ингибированию восстановления тетранитротетразолиевого синего пероксидными радикалами, генерированными в реакции окисления ксантина ксантиноксидазой. За единицу активности принимали количество бесклеточного экстракта (в мл), вызывающего 50%-ное ингибирование. Активность выражали количеством единиц на 1 мг белка в бесклеточном экстракте (Вартанян Л.Ф., Гуревич С.М., 1982).
Марганецсодержащая супероксиддисмудисмутаза обнаружена, например, у молочнокислых бактерий, дрожжей, стрептококков, при этом соли марганца заметно стимулируют активность этого фермента (Нефедова Н. В., Козаченко А. И., Наглер Л. Г., Гуревич С.М., 2003).
Пероксид-дисмутаза катализирует реакцию дисмутации путем восстановления перекисных радикалов, например:
Источником пероксид-аниона (О-2) в молоке являются реакции, катализируемые, например, ксантиноксидазой, лактопероксидазой, β-галактозидазой, а также реакции одновалентного восстановления кислорода рибофлавином. При световом освещении (λ = 400...500 нм) молока происходит окисление рибофлавином аминокислот – в основном метионина (реже гистидина, триптофана, тирозина и цистеина), в результате чего также образуются пероксид-анионы. При насыщении пероксид-дисмутазы пероксид-анионом образуется большое количество перекиси водорода, а имеющейся в молоке каталазы может быть недостаточно для ее окисления. Вместе с тем, пероксид-анион может реагировать с ионами металлов, снижая их валентность, например:
Образованные гидроксильные радикалы очень нестабильны и могут реагировать, например, с карбонатами, которые затем инициируют антиокислительный эффект (Hicks С. L., 1980).
Активность пероксид-дисмутазы в коровьем молоке составляет в среднем ≈ 1 Е/мл (≈ 16,7 нкат) при 24°С (по Grün E., 1985), что в ≈ 150 раз ниже, чем в крови.
Наличие в молоке пероксид-дисмутазы имеет важное значение для степени и направления развития окислительных процессов в молоке, поскольку она регулирует концентрацию активных форм кислорода. Пероксид-дисмутаза, катализируя процесс утилизации этих соединений, предотвращает окисление ими липидов и других биологических веществ в молоке, наряду с каталазой и лактопероксидазой (Вартанян Л. Ф., Гуревич С. М., 2003; Павлова Е. С., Маликова Н. В. и др., 2004).
В заключение следует отметать, что, поскольку в реакциях, катализируемых глюкозооксидазой, ксантиноксидазой, аминоксидазой, сульфгидрилоксидазой и пероксид-дисмутазой, образуется перекись водорода, эти ферменты выполняют в сыром молоке важную биологическую функцию, являясь естественным источником перекиси водорода, которая совместно с лактопероксидазой молока и тиоцианатом обусловливает действие лактопероксидазо-антибактериальной системы молока (см. п. 2.3). Кроме того, оксидазы, используя в качестве акцептора водорода кислород, являются, в какой-то степени, антиокислителями липидов молока.
[1] 1.1.1.1 – здесь и далее по классу оксидоредуктаз – шифр, или кодовый номер в соответствии с номенклатурой ферментов. Первое число означает класс фермента, второе число (подкласс) указывает вид группы в субстрате, подвергающейся окислению; третье число (подподкласс) указывает на тип используемого акцептора; четвертое число – порядковый номер фермента в данном подподклассе.
[2] 1 усл. ед. соответствует количеству фермента, который в присутствии 1 мг кстантина вызывает обесцвечивание 0,1 мл 0,0113 М раствора метиленового голубого за 1 мин при 38°С.
[3] Исходное обсеменение E. coli – 2,5 · 106 КОЕ/мл (Björck L., Claesson O., 1979).