Совокупность характеристик, отражающих потребности дрожжевых организмов в определенных физико-химических условиях среды, относят к физиологическим признакам. Из этих признаков для целей идентификации используют следующие: способность к сбраживанию сахаров до углекислого газа и этанола в анаэробных условиях (брожение), усвоение безазотистых источников углерода путем их окисления в аэробных условиях (ассимиляция), потребление различных источников азота, рост на среде без витаминов, максимальные для роста температуры, способность расти при повышенном осмотическом давлении среды и пр. В технологическом смысле все перечисленные свойства имеют большее или меньшее значение.
Общими требованиями при проведении физиологических тестов являются использование при этом свежих (обычно 1–2-суточных) активно растущих культур дрожжей, высокоочищенных препаратов веществ, не содержащих примесей, которые могут обусловить ложные результаты, и культивирование организмов при оптимальных для их роста температурах.
12.1. ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ БРОЖЕНИЯ И ДЫХАНИЯ
Уровни интенсивности дыхания (QO2) и интенсивности брожения (QCO2) измеряют у молодых клеток, исследуемых на одной стадии развития, культивируемых на одной и той же синтетической среде, содержащей глюкозу и полной с точки зрения содержания минеральных и азотсодержащих веществ, а также витаминов. Измерения производят на приборе для определения энергии дыхания и брожения микроорганизмов Одинцовой (рис. 28) или манометрическим способом на аппарате Варбурга (рис. 29) для газообмена.
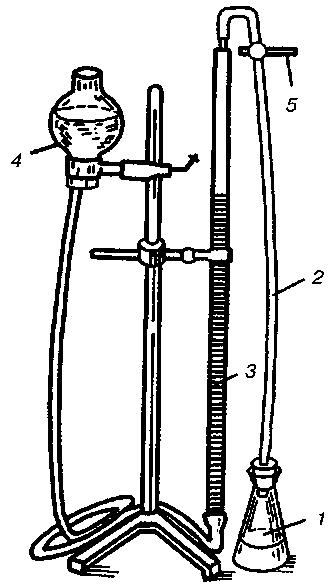
Рис. 28
Прибор Одинцовой:
1 – бродильный сосуд; 2 – соединительная трубка; 3 – бюретка;
4 – уравнительный сосуд; 5 – трехходовой кран.
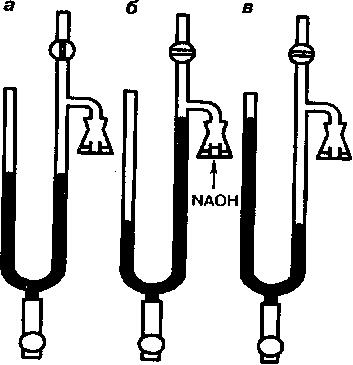
Рис. 29
Аппарат Варбурга:
а – исходное положение манометра; б – измерение интенсивности дыхания;
в – измерение интенсивности брожения.
В аппарате Варбурга и в приборе Одинцовой газометрическая часть состоит из тонких стеклянных трубок с делениями, снабженных пришлифованными кранами, позволяющими регистрировать выделяющийся углекислый газ (брожение) и поглощение кислорода (дыхание) дрожжами определенной массы в течение короткого времени.
Подготовка культуры. Чашки Петри с богатой питательной средой (сусло-агар с 0,3% дрожжевого автолизата) засевают экспериментальными расами.
Через 5–7 суток культивирования в термостате посев смывают с чашек стерильной водой, отфильтровывают и промывают также водой на воронке Бюхнера, затем отпрессовывают между листиками фильтровальной бумаги, и берут по весу для приготовления суспензии.
Брожение проводят с 2% отпрессованных дрожжей на 4%-ном растворе глюкозы в буферной смеси по Мак-Ильвейну (лимонная кислота и двухосновный фосфорнокислый натрий в концентрации 1/20 моля). Сахарный раствор вносится в боковую ампулу.
Для определения дыхания используют 0,5% отпрессованных дрожжей и однопроцентный раствор сахара (можно готовить из суспензии, приготовленной для определения брожения).
Длительность опытов – 2 ч при температуре 28°С.
Показатель количества углекислого газа в см3, выделенного за 1 ч на 1 мг дрожжей (может быть в атмосфере СO2 или другого инертного газа) обозначают QCO2; показатель количества кислорода в см3, поглощенного за 1 ч на 1 мг дрожжей, обозначают QO2.
Дрожжи по этим показателям различаются:
- только окисляющие;
- обладающие равной интенсивностью и дыхания, и брожения;
- имеют достаточно высокую окислительную способность и малоактивны по брожению;
- интенсивность брожения высокая при относительно низкой интенсивности дыхания;
- слабая интенсивность дыхания и не очень высокая брожения.
Для характеристики истинных бродильных свойств различных рас производственных дрожжей используют коэффициент – отношение интенсивности брожения к интенсивности дыхания (QCO2/QO2). Чем выше этот показатель, тем выше энергия брожения расы дрожжей в определенных условиях.
Работая на этих аппаратах, удобно вести исследования по влиянию условий культивирования дрожжей и воздействию факторов роста и активаторов брожения.
Процентное содержание дыхательного фермента клетки изменяется в зависимости от степени аэрации питательной среды. В противоположность этому интенсивность сбраживания является относительно постоянной в течение всего периода брожения и снижается только к его концу, когда число живых клеток уменьшается. Интенсивность сбраживания выражают в мм3 газа на 1 мг дрожжей в час.
Лафон разделил дрожжи по этому признаку на шесть групп.
- Дрожжи только окисляющие. Debaryomyces, выделенные из вин, и С. vini не вызывают сбраживания сахаров или сбраживают их только в виде следов. Интенсивность дыхания равна примерно 25.
- P. fermentans и Н. anomala имеют интенсивность дыхания, часто равную и иногда превосходящую интенсивность сбраживания.
- M. pulcherrima имеет достаточную окислительную способность и малоактивна с точки зрения сбраживания. Отношение дыхания к брожению равно 30:90.
- Для Sacch. bailii дыхание составляет от 13 до 18%. В эту же категорию входят виды Hanseniaspora. Интенсивность сбраживания составляет от 100 до 150 при интенсивности дыхания от 15 до 20.
- У рода Saccharomyces отношение дыхания к брожению всегда ниже 10% при интенсивности брожения от 200 до 300. Такие же данные и у Torulopsis stellata при несколько более слабой интенсивности брожения.
- Brettanomyces – дрожжи с замедленным метаболизмом, имеют слабую интенсивность дыхания при интенсивности сбраживания около 50.
Для описания и идентификации микроорганизмов широко используют некоторые особенности их обмена веществ, выявляемые по способности изучаемого организма расти на принятых в настоящее время диагностических средах и вызывать те или иные превращения веществ, входящих в состав этих сред. Эмпирически давно отмечено, что немало характеристик дрожжей, в том числе и физиологических, взаимосвязаны. Подобные корреляции полезно помнить, так как они могут служить дополнительным контролем и предостеречь от грубых ошибок. Применительно к сбраживанию сахаров наиболее общими являются два правила:
- если дрожжи сбраживают какой-либо сахар, то они могут сбраживать и глюкозу;
- если дрожжи сбраживают какой-либо сахар, то они могут также его ассимилировать. Обратное – неверно.

Рис. 30
Накопление газа в поплавке:
1 – рост культуры сопровождается образованием газа;
2 – газ не образуется.
Наиболее простыми и общедоступными для установления способности дрожжей к сбраживанию сахаров являются методы:
- с использованием трубок Дунбара;
- с использованием трубок Дурхэма (поплавков), показанных на рисунке 30;
- посев в столбик полужидкого агара.
Для получения концентрации 2% (раффинозы 4–6%) отдельные сахара растворяют в разведенном в соотношении 1:10 дрожжевом автолизате или в 0,5%-ном растворе дрожжевого экстракта. Использование в качестве растворителя дрожжевой воды не рекомендуется, поскольку она часто содержит значительные количества трегалозы, которая может сбраживаться дрожжами.
Чтобы обнаружить изменение рН, к среде добавляют индикатор – бромкрезоловый пурпурный – из расчета 2 см3 1,6%-ного спиртового раствора на 1 л среды. При рН 6,8 индикатор имеет пурпурный, а при рН 5,2 – желтый цвет. Можно использовать в такой же концентрации бромтимоловый голубой, который при рН 6,0 желтого, а при рН 7,6 синего цвета.
С использованием трубок Дунбара. Растворы сахаров разливают по трубкам Дунбара и автоклавируют 15 мин при 112°С. При этом в слепом колене трубки нередко образуются пузырьки воздуха. Перед засевом, осторожно наклоняя трубку, их необходимо удалить. Посев производят культурами с сусло-агара или 0,1–0,2 см3 суспензии клеток исследуемых дрожжей. Инкубация длится от 24 ч до 10 суток.
О способности к сбраживанию сахара свидетельствует образование газа в закрытом колене трубки.
С использованием поплавков. Приготовленные растворы сахаров разливают по пробиркам на 1/2 объема, в которые для определения газообразования опускают поплавки запаянным концом вверх (трубочки, диаметром 5–7 мм, длиной 35–45 мм, запаянные с одного конца). Горлышко пробирки закрывают большим пальцем и, осторожно переворачивая, заполняют поплавок жидкой средой. Пробирки закрывают ватно-марлевыми пробками и автоклавируют 20 мин при 0,1 МПа. После автоклавирования среда из поплавков вытесняется, но по мере охлаждения поплавки снова заполнятся.
Посев производят культурами с сусло-агара или 0,5–1,0 см3 суспензии клеток исследуемых дрожжей.
При необходимости соблюдения анаэробных условий инкубирования, после посева поверхность среды заливают стерильным парафином, стерильным вазелиновым маслом или их стерильной смесью 1:1.
Инкубация длится от 24 ч до 10 суток.
О способности к сбраживанию данного углевода свидетельствует газообразование и вытеснение питательной среды из поплавка.
Посев в столбик полужидкого агара. В приготовленные растворы сахаров вносят 0,5% агара, 0,3% дрожжевого автолизата, кипятят до полного растворения, разливают в пробирки на 1/2 объема, автоклавируют 20 мин при 0,1 МПа. Из автоклава пробирки переносят в штатив и выдерживают вертикально до полного охлаждения.
Посев производят бактериологической иглой уколом до дна пробирки культурами с сусло-агара или суспензии клеток исследуемых дрожжей.
При необходимости соблюдения анаэробных условий инкубирования после посева поверхность среды заливают стерильным парафином, стерильным вазелиновым маслом или их стерильной смесью 1:1.
Инкубация длится от 24 ч до 10 суток.
О способности к сбраживанию данного углевода свидетельствует газообразование и разрывы столбика полужидкого агара. Для учета полученных результатов можно использовать таблицу 13.
Таблица 13
Показатели роста исследуемых культур дрожжей на средах с углеводами и спиртами
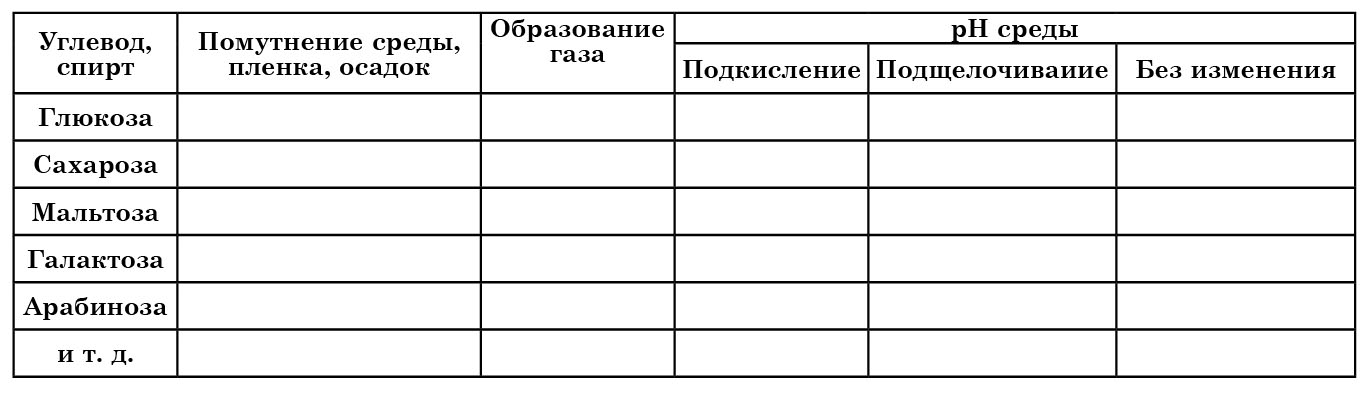
Микроорганизмы характеризуются неодинаковой способностью использовать различные углеводы и спирты в качестве единственных источников углерода и энергии. Перечень сахаров и других органических соединений, способность к сбраживанию (либо ассимиляции) которых определяют при идентификации дрожжей, включает:

________________________
Трисахариды
* Используются в тестах как на ассимиляцию, так и на брожение.
Таблица 14
Возможные варианты сбраживания раффинозы дрожжами
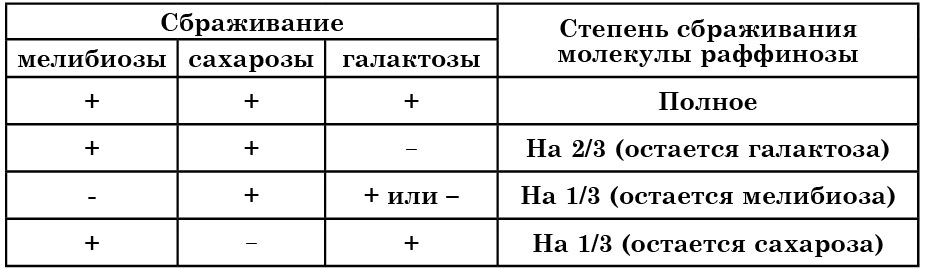
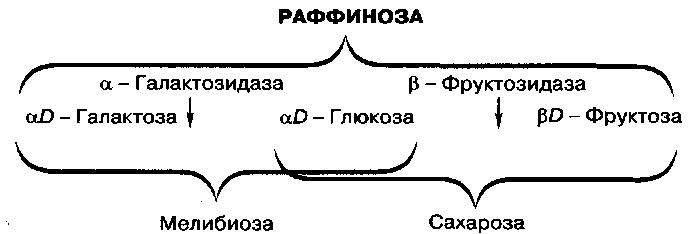
Рис.31
Структура молекулы раффинозы
Из перечисленных углеводов специального рассмотрения требует раффиноза, поскольку этот трисахарид может по-разному сбраживаться дрожжами: полностью, на 2/3 или же на 1/3 молекулы, что учитывается при идентификации (табл. 14). О том, насколько полно и каким образом сбраживается раффиноза исследуемыми дрожжами, можно судить по способности к сбраживанию сахаров, входящих в состав молекулы раффинозы (рис. 31), или определением остаточных сахаров в среде.
12.3. ИЗБИРАТЕЛЬНОЕ СБРАЖИВАНИЕ ГЛЮКОЗЫ И ФРУКТОЗЫ
Известно, что в присутствии смеси глюкозы и фруктозы, такой как инвертный сахар, дрожжи сбраживают прежде всего глюкозу и после этого поглощают фруктозу. Но некоторые дрожжи ведут себя по-другому. При расчете процентного содержания сброженной глюкозы, когда 50% фруктозы уже сброжено, различают три категории дрожжей:
- Дрожжи, сбраживающие к этому моменту от 80 до 85% глюкозы. Это наиболее многочисленные, глюкозофильные дрожжи. К этой категории относится большая часть видов Saccharomyces, а также Saccharomycodes и Brettanomyces.
- Дрожжи, которые предпочтительно поглощают фруктозу или фруктозофильные; они используют в этих условиях только от 5 до 10% глюкозы. Их представляют три вида: Sacch. bailii, Sacch. roxii и Т. stellata.
- Дрожжи, разлагающие оба сахара с почти одинаковой скоростью, во всяком случае с начала брожения. К моменту, когда они поглощают половину фруктозы, исчезает от 40 до 60% глюкозы. В эту категорию входит восемь видов дрожжей, в том числе виды Hanseniaspora.
12.4. ЗИМАЗНАЯ, ИНВЕРТАЗНАЯ И МАЛЬТАЗНАЯ АКТИВНОСТЬ
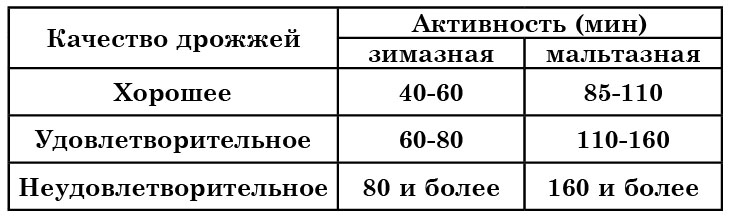
Зимазная, инвертазная и мальтазная активность – основные с технологической точки зрения показатели ферментативной активности дрожжей.
Например, для оценки качества хлебопекарных дрожжей приняты показатели ферментативной активности, представленные в таблице 15.
12.4.1. ГАЗОМЕТРИЧЕСКИЙ СПОСОБ
По скорости сбраживания дрожжами глюкозы, сахарозы и мальтозы определяют соответственно зимазную, инвертазную и мальтазную активность, выражаемую во времени, необходимом для выделения 10 см3 СO2 из 5%-ного раствора сахара. Для определения пользуются микрогазометром системы Елецкого (см. рис. 32), изготовляемым на месте.
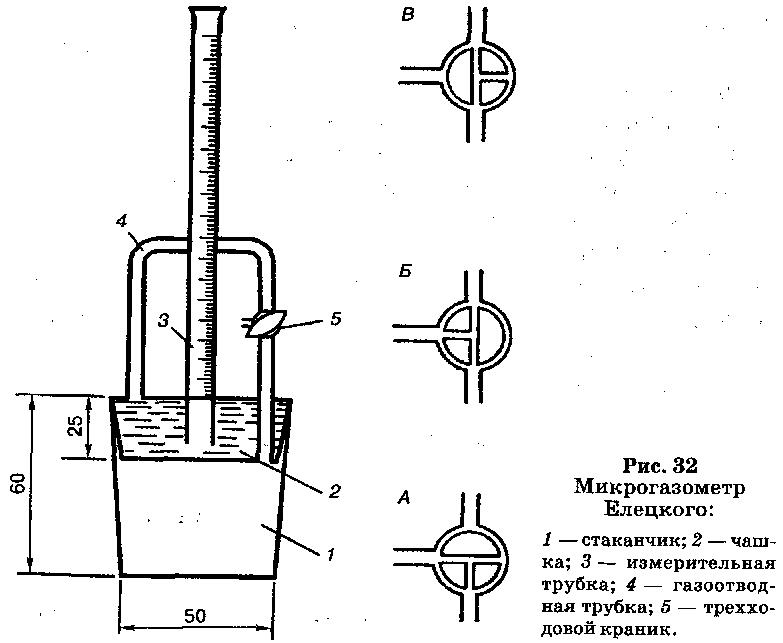
Прибор состоит из стаканчика 1 и манометрической крышки, соединяемых при помощи шлифованной поверхности. Диаметр стаканчика (внутренний) равен 50 мм, высота – 60 мм. Манометрическая крышка состоит из чашки 2 диаметром (внешний) 50 мм, высотой 25 мм и измерительной трубки 3 высотой 250 мм и внутренним диаметром 8–10 мм. В манометрической крышке имеется изогнутая газоотводная трубка 4 внутренним диаметром 3 мм с трехходовым краном 5, при помощи которого газоотводная труба соединяется как с внутренней камерой газомера – стаканчиком, так и с внешней средой.
Перед началом работы в манометрическую крышку заливают насыщенный раствор поваренной соли, подкрашенный метиленовым синим. Раствор наливают до основания измерительной трубки, и этот уровень принимают за ноль, все шлифы смазывают вазелином.
Измерительную трубку градуируют с точностью до 1 см3. Высоту h 1 см3 на измерительной трубке вычисляют по следующей формуле:
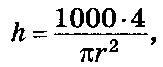
где r – радиус измерительной трубки, см3, r = 4 мм.
Подставив это значение в формулу, получим
![]()
0,5 г прессованных товарных дрожжей, или отпрессованных на воронке, или снятых с поверхности плотной агаризованной среды, помещают в стаканчик прибора, заливают 10 см3 водопроводной воды температурой 35°С и размешивают. К полученной суспензии добавляют 10 см3 10%-ного раствора сахара (глюкозы, сахарозы или мальтозы) и быстро закрывают стаканчик манометрической крышкой, предварительно переведя трехходовой кран 5 в положение А. Затем кран переводят в положение Б для выравнивания давления внутри прибора с атмосферным давлением. После этого кран переводят в положение В и прибор помещают в термостат при температуре 35°С, засекают время и наблюдают за прибором, пока не выделится 10 см3 диоксида углерода и жидкость в измерительной трубке не поднимется на соответствующую высоту. Время, затраченное на выделение 10 см3 газа, выраженное в минутах, называют зимазной, инвертазной или мальтазной активностью при использовании соответственно глюкозы, сахарозы или мальтозы.
После окончания анализа кран на газоотводной трубке переводят в положение Б, чтобы жидкость в трубке опустилась, и разъединяют манометрическую трубку и стаканчик. Из стаканчика выливают жидкость, ополаскивают его водой и вытирают досуха.
12.4.2. МАНОМЕТРИЧЕСКИЙ СПОСОБ***
Для определения ферментативной активности предлагается прибор (см. рис. 22), состоящий из колбы (100–120 см3), газоотводной трубки с краном и чувствительного манометра (медицинский, для измерения артериального давления).
Перед началом работы измерить объем используемой колбы до нижнего края тщательно притертой резиновой пробки и объем проходящей через пробку газоотводной трубки. Для этого заполнить колбу и трубку водой, а затем измерить объем вместившейся жидкости мерным цилиндром. Полученную величину нанести на колбу и в дальнейшем использовать как «постоянную».
В колбу поместить 0,5 г прессованных дрожжей, залить 10 см3 водопроводной воды температурой 35°С и размешать до однородной суспензии. Затем добавить 10 см3 5%-ного раствора сахара (глюкозы, сахарозы или мальтозы) и закрыть колбу резиновой пробкой с газоотводной трубкой, соединенной с манометром. Для уравнивания давления в колбе с атмосферным давлением извлечь подвижную часть краника и сразу поместить его на место, тщательно притерев и совместив отверстия. Подготовленный таким образом прибор поместить в термостат при 35°С (308 К) и регистрировать время, за которое стрелка манометра достигнет необходимой отметки, соответствующей 10 см3 выделенного углекислого газа.
Величину давления в определенном ранее объеме используемой колбы определить по уравнению Менделеева-Клапейрона:
![]()
где т – масса газа; М = 44 г; р = 700 мм рт. ст.; R = 62 360 мм рт. ст./моль К; V = 10 см3;
Т = 308 К.
Тогда
![]()
Таким образом, установлено, что в состоянии реального газа масса 10 см3 диоксида углерода равна 0,016 г.
Для приведения давления газа в условия эксперимента формулу (1) преобразовали
![]()
где рх – показание манометра; m = 0,016 г; R = 62 360 мм. рт. ст./моль К; Т = 308 К;
Vх = 104 см3; М = 44 г.
Значение Vх определяется вычитанием объема дрожжевой суспензии (20,5 см3) из общего объема в системе (124,5 см3). Тогда
![]()
где рх – давление, создаваемое газом массой 0,016 г и объемом 10 см3 в используемом объеме Vх при температуре Т.
При условии, что в дальнейшей работе значения R, М и т будут использоваться как «постоянные», получится формула
![]()
На основании произведенных расчетов установлено, что, используя прибор с постоянным свободным объемом (в приведенном примере – 104 см3), остается лишь регистрировать время, за которое стрелка манометра достигнет необходимой отметки (в приведенном примере – 67 мм рт. ст.).
Если за единицу измерения будет принят 1 Па, данная формула будет представлена как:
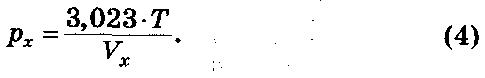
При брожении наряду с этиловым спиртом и углекислым газом образуется ряд побочных и вторичных продуктов. Эквивалентность между глицерином (Г) и суммой других вторичных продуктов: уксусной кислоты (У), янтарной кислоты (Я), 2,3-бутандиола (Б), ацетоина (А), остаточного свободного ацетальдегида (Э) – с коэффициентом при каждом из них, выведенным из химического уравнения, установлена аналитически.
Предложено уравнение, вытекающее из баланса спиртового брожения Нейберга:
5Я + 2У + Б + 2А + Э = Σ £ Г.
Это уравнение эквивалентности (Σ от 0,8 до 1,0) подтверждается для всех дрожжей, имеющих только бродильный тип обмена веществ. Для других групп дрожжей это отношение действительно только в условиях абсолютного анаэробиоза и не подходит для среды с доступом воздуха.
Для характеристики рас дрожжей, особенно промышленного назначения, необходимы сведения об образовании ими продуктов брожения, имеющих весьма важное значение в формировании конечного продукта.
Способность дрожжей синтезировать все необходимые для роста витамины или потребность в наличии каких-либо из них в среде используют при идентификации видов в качестве дополнительных характеристик. Нельзя недооценивать и технологическое значение этого фактора.
В некоторых случаях потребность в определенных витаминах присуща всем представителям рода. Например, все виды Hanseniaspora, Kloeckera нуждаются в инозите и пантотеновой кислоте. В других родах зависимость по каким-либо витаминам или способность расти на безвитаминной среде характерны для отдельных видов или даже разновидностей. Наиболее часто дрожжи нуждаются в обеспечении биотином и тиамином.
Постановка теста на способность к росту в среде без витаминов (см. табл. 6) и определение их значения как факторов роста осуществляются аналогично постановке тестов на способность к ассимиляции источников углерода. Поскольку дрожжи способны накапливать в клетках значительные количества витаминов, для приготовления инокулята в данном тесте используют культуры дрожжей, предварительно выращенные в безвитаминной среде.
Интенсивность брожения или накопления биомассы на жидких и плотных средах свидетельствует о значении данного витамина как фактора роста для исследуемой культуры дрожжей. Медленный и слабый рост на безвитаминной основе рассматривают как неспособность исследуемых организмов синтезировать все необходимые для роста витамины.
Для всех видов дрожжей, использующихся в промышленности, характерна специфическая потребность в том или ином факторе роста: мезоинозит, биотин, пиридоксин, тиамин, пантотеновая кислота, никотинамид, парааминобензойная кислота.
Для исследований используется безвитаминная среда.
Для каждой культуры готовят восемь пробирок; одна пробирка без факторов роста, другая – получает все, за исключением одного, каждый раз разного. Пробирки засевают минимальным количеством клеток (1–2 клетки на 1 мм3, микрозасев).
Для анализа опытов используют нефелометрирование, или подсчет клеток в счетных камерах, а также взвешивание хорошо укупоренных пробирок.
В результате получают данные как по скорости роста и накопления биомассы, так и по скорости и пределу сбраживания сахара.
В результате построения витаминограмм можно отобрать тест-культуры для определения того или иного фактора роста – витамина.
12.7. РОСТ НА СРЕДАХ С ПОВЫШЕННЫМ ОСМОТИЧЕСКИМ ДАВЛЕНИЕМ
Под осмотической устойчивостью понимают приобретенную способность некоторых рас и культур дрожжей сохранять ферментативную активность в средах с относительно высоким осмотическим давлением. Это свойство следует отличать от осмофильности, которая является генетически закрепленным признаком отдельных родов и видов дрожжей, обитающих в специфических экологических условиях.*** При этом следует понимать, что дрожжи, устойчивые к высоким осмотическим давлениям, создаваемым в среде глюкозой, не всегда так же устойчивы к давлениям, создаваемым солями.
Определить способность культуры сохранять свою жизнедеятельность в средах с высоким осмотическим давлением важно не только для выделения и идентификации осмофильных дрожжей. Данный показатель имеет значение при выборе рас, используемых в производстве хлебопекарных дрожжей, как фактор, влияющий на стойкость готовой продукции и ее технологические особенности. Кроме того, в последние годы в селекции пивных и спиртовых рас все большее внимание уделяют осмотической устойчивости, исходя из технологических и экономических предпосылок.
12.7.1. ОТНОШЕНИЕ К КОНЦЕНТРАЦИИ ХЛОРИСТОГО НАТРИЯ
Устойчивость разных видов дрожжей к этому фактору заметно варьирует. Большую или меньшую чувствительность дрожжей к концентрации соли оценивают по их способности расти в среде, обеспечивающей хороший рост с 2,5 и 6,5% NaCl. Исследуют устойчивость чистой культуры дрожжей из лабораторной коллекции или выделенной из производственного либо природного субстрата.
Для этих целей можно использовать жидкие, полужидкие и плотные среды.
На жидких средах.
Вариант 1.
Глюкоза.......................................... 2,0 г
Дрожжевой автолизат.................. 0,5 см3
NaCl.............................................. 0–10,0 г
Вода..................................... до 100,0 см3
Вариант 2.
Глюкоза.......................................... 2,0 г
Дрожжевой экстракт ...................... 0,5 г
Пептон............................................. 1,0г
NaCl........................................... 0–10,0 г
Вода..................................... до 100,0 см3
Среду разливают в пробирки и стерилизуют при 0,1 МПа. Через 6–10 суток после посева по помутнению среды или образованию осадка регистрируют рост микроорганизмов и его интенсивность или отсутствие роста и делают заключение о чувствительности изучаемого микроорганизма к концентрации хлористого натрия.
Концентрация соли, при которой еще регистрируется рост исследуемой культуры дрожжей, принимается за показатель ее галотолерантности.
На жидких средах с использованием поплавков.*** Приготовленные солесодержащие среды разливают по пробиркам на 1/2–2/3 объема, в которые для определения газообразования опускают поплавки. Горлышко пробирки закрывают большим пальцем и, осторожно переворачивая, заполняют поплавок жидкой средой. Пробирки закрывают ватно-марлевыми пробками и автоклавируют 20 мин при 0,1 МПа. После автоклавирования среда из поплавков вытесняется, но по мере охлаждения поплавки вновь заполнятся.
Посев производят культурами с сусло-агара или 0,5–1,0 см3 суспензии клеток исследуемых дрожжей.
При необходимости соблюдения анаэробных условий инкубирования после посева поверхность среды заливают стерильным парафином, стерильным вазелиновым маслом или их стерильной смесью 1:1.
Инкубация длится от 24 ч до 10 суток.
О способности исследуемой культуры дрожжей расти при данной концентрации соли свидетельствует газообразование и вытеснение питательной среды из поплавка.
Концентрация соли, при которой еще регистрируется рост исследуемой культуры дрожжей, принимается за показатель ее галотолерантности.
На полужидких средах.*** В жидкие фоновые среды (варианты 1 и 2) вносят 0,5% агара, кипятят до полного его растворения, разливают в пробирки на 1/2 объема, автоклавируют 20 мин при 0,1 МПа. Из автоклава пробирки переносят в штатив и выдерживают вертикально до полного охлаждения.
Посев производят бактериологической иглой уколом до дна пробирки культурами с сусло-агара или суспензии клеток исследуемых дрожжей.
При необходимости соблюдения анаэробных условий инкубирования после посева поверхность среды заливают стерильным парафином, стерильным вазелиновым маслом или их стерильной смесью 1:1.
Инкубация длится от 24 ч до 10 суток.
О способности исследуемой культуры дрожжей расти при данной концентрации соли свидетельствует газообразование и разрывы столбика полужидкого агара.
Концентрация соли, при которой еще регистрируется рост исследуемой культуры дрожжей, принимается за показатель ее галотолерантности.
На плотных средах. В жидкие фоновые среды (варианты 1 и 2) вносят 2,5% агара, кипятят до полного его растворения, переливают в коническую колбу на 1/2 объема, закрывают ватно-марлевой пробкой и автоклавируют 20 мин при 0,1 МПа. Сразу после автоклавирования разливают в заранее приготовленные стерильные высушенные чашки Петри. Когда агар полностью застынет, чашки необходимо подсушить.
Посев производят бактериологической петлей или шпателем Дригальского культурами с сусло-агара или суспензии клеток исследуемых дрожжей.
Объем инокулята должен предполагать обязательное получение изолированных колоний после инкубации, что позволит не только выявить наличие или отсутствие роста при определенной концентрации соли, но и определить возможное влияние на культуральные свойства, т. е. на состояние клеточной массы.***
Инкубация длится от 24 ч до 10 суток.
При учете результатов регистрируют наличие или отсутствие роста дрожжей, его интенсивность и возможные отклонения в структуре колоний от таковых на контрольной среде.
Концентрация соли, при которой еще регистрируется рост исследуемой культуры дрожжей, принимается за показатель ее галотолерантности.
По разнице в подъемной силе. На технических весах берут две навески испытуемых дрожжей по 0,31 г каждая. К первой навеске добавляют 4,8 см3 водопроводной воды, нагретой до 35°С, тщательно размешивают с помощью шпателя или пестика в фарфоровой чашке или в ступке, добавляют муку 85%-ного помола от 6,5 до 7,5 г (в зависимости от ее влажности) и быстро замешивают тесто, придавая ему форму шарика, не прилипающего к рукам.
Таблица 16
Технологические параметры осмотической устойчивости хлебопекарных дрожжей
Шарик опускают в стакан или цилиндр с водой при температуре 32°С, засекают время и поддерживают эту температуру до всплывания шарика.
Ко второй навеске добавляют 4,8 см3 3,35%-ного раствора поваренной соли, нагревают до 35°С и далее поступают так же, как с первой навеской.
Время, затраченное на всплывание шариков (мин), умножают на коэффициент 3,5 и получают величину подъемной силы, определяемую стандартным способом.
Шарик, замешенный на воде без соли, всплывает быстрее. Разница в подъемной силе дрожжей в зависимости от осмотического давления среды, выраженная в минутах, характеризует осмоустойчивость, которую рассматривают как косвенный показатель стойкости дрожжей.
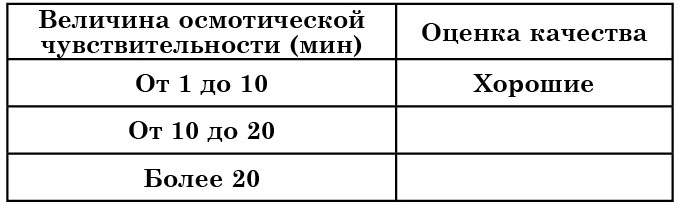
Дрожжи с осмоустойчивостью в пределах 10–15 мин стойки при хранении и вполне пригодны для сушки.
Для прессованных хлебопекарных дрожжей в зависимости от их осмотической устойчивости приняты показатели качества, указанные в таблице 16.
12.7.2. ОТНОШЕНИЕ К КОНЦЕНТРАЦИИ ГЛЮКОЗЫ
Стандартный метод. Готовят среду следующего состава.
Глюкоза...................................................... 50 (60) г
Дрожжевая вода
(или 1% -ный раствор
дрожжевого автолизата)...................... 50 (40) см3
Агар................................................................... 2,5 г
Среду кипятят до полного растворения агара, автоклавируют 15 мин при 112°С и разливают по чашкам.
Посев на чашки производят бактериологической петлей или шпателем Дригальского культурами с сусло-агара или суспензии клеток исследуемых дрожжей.
Объем инокулята должен предполагать обязательное получение изолированных колоний после инкубации, что позволит не только выявить наличие или отсутствие роста при определенной концентрации глюкозы, но и определить возможное влияние на характер колоний, т. е. на состояние клеточной массы.***
Инкубация длится от 24 ч до 10 суток.
Концентрация глюкозы, при которой еще регистрируется рост исследуемой культуры дрожжей, принимается за показатель ее осмотической устойчивости.
Основным недостатком метода можно считать обильное вытеснение сиропа на поверхность застывшего агара при высоких концентрациях сахара. Это исключает возможность получения изолированных колоний и их характеристики.***
В полужидком глюкозно-дрожжевом агаре.*** Питательная среда включает следующие ингредиенты.
Глюкоза...................................... 40–70 г
Дрожжевой автолизат.................. 0,5 см3
Агар................................................ 0,5 г
Вода..................................... до 100,0 см3
Среду кипятят на медленном огне до полного растворения агара, разливают в пробирки высоким столбиком и стерилизуют при 0,1 МПа в течение 20 мин.
Полученный таким образом полужидкий агар застывает однородной массой, и независимо от концентрации глюкозы на поверхности среды нет капель вытесненного сиропа.
Посев исследуемой культуры производят бактериологической иглой глубоким уколом до дна пробирки.
При необходимости соблюдения анаэробных условий инкубирования после посева поверхность среды заливают стерильным парафином, стерильным вазелиновым маслом или их стерильной смесью 1:1.
Инокулированные среды инкубируют при 30°С в течение 7 дней.
Наличие роста регистрируют по образованию пузырьков газа и разрывам питательной среды по всей длине укола.
При учете результатов отмечают наибольшую концентрацию глюкозы, при которой еще регистрируется рост, и принимают ее за показатель осмотической устойчивости исследуемой культуры дрожжей.
12.8.1. ОПРЕДЕЛЕНИЕ ОПТИМАЛЬНОЙ ТЕМПЕРАТУРЫ ДЛЯ РОСТА
В последние годы способность дрожжей к росту при определенных температурах все чаще вводят в ключи в качестве дифференцирующего признака. Подавляющее большинство дрожжей, имеющих технологическое значение, относится к мезофилам. Однако оптимальная температура для роста микроорганизмов этой группы имеет достаточно широкий диапазон. Поэтому необходимо определить температуру, обеспечивающую физиологически сбалансированный рост изучаемой культуры. Для этого штрихом бактериологической петлей или сплошным посевом шпателем Дригальского засевают в двух повторениях плотные питательные среды в чашках Петри или скошенные в пробирках. Посевы помещают в термостат с температурой 15, 20, 25, 30, 35, 40, 43, 45 и 48°С. Для низовых пивных дрожжей температурный интервал следует устанавливать в пределах технологических требований.
В зависимости от скорости роста через 3–5–7 суток отмечают интенсивность роста исследуемого организма визуально по 4-балльной шкале: «0» – отсутствие роста, «+» – слабый рост, «++» – хороший рост, «+++» – очень хороший рост.
После первого пассажа проводят второй пассаж, с той лишь разницей, что для каждой температуры посевным материалом служат клетки соответствующего предыдущего пассажа. Чашки вновь помещают в термостаты с различной температурой и через 3–5–7 суток отмечают рост и его интенсивность. Количество пассажей определяется исследователем, но, как правило, проводят три пассажа. Температура, при которой исследуемая культура дает одинаково интенсивный рост (без изменения культуральных признаков***) в как минимум трех пассажах считается оптимальной.
Таблица 17
Интенсивность роста исследуемых дрожжей в зависимости от температуры
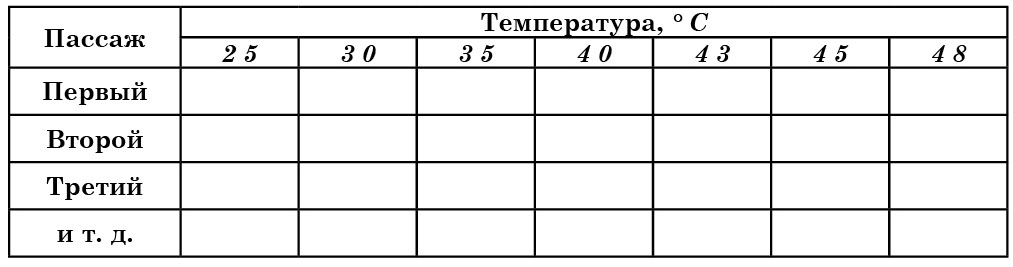
Для записи результатов наблюдений можно использовать таблицу 17.
На основании полученных результатов делают вывод об оптимальной температуре для роста изучаемой культуры.
При определении температуры, оптимальной для роста представителей психрофилов или термофилов, используют другие диапазоны температур: соответственно от –5 до 20° и от 50 до 80°С.
12.8.2. ХОЛОДО- И ТЕРМОУСТОЙЧИВОСТЬ ДРОЖЖЕЙ
Брожение сусла при температурах ниже 10°С и выше 30°С часто заканчивается недобродом, т. е. неполным сбраживанием сахаров сусла. Для сбраживания сусла при низких и высоких температурах целесообразно применять холодо- и термоустойчивые расы дрожжей.
Для отбора холодоустойчивых культур изучают бродильную способность (скорость и полноту сбраживания 18–20% сахаров в сусле) при температуре 7–10°С и отбирают те расы, которые начинают размножаться и сбраживают сусло быстрее и полнее других. При температуре 30–35°С этими дрожжами сбраживается лишь около 50% сахаров.
Для отбора термоустойчивых культур изучают бродильную способность при температуре 30–35°С и отбирают те расы дрожжей, которые начинают размножаться и сбра–живать сусло быстрее и полнее других при этой температуре.
Методика постановки опытов и контроль за ходом брожения описаны в п. 13.2.
Для получения более объективной информации следует использовать микроскопические методы оценки качественных и количественных параметров состояния исследуемых культур дрожжей.***
Кроме того, важным показателем физиологического состояния исследуемой культуры и возможности ее технологического использования могут служить образующиеся в данных температурных условиях продукты брожения и степень отличия их количества от таковых при оптимальном температурном режиме. Для этого можно использовать формулу
5Я + 2У + Б + 2А + Э = Σ £ Г,
описанную в п. 12.5.***
Целесообразно при отборе новых холодо- и термовыносливых рас дрожжей в качестве контроля брать музейные расы, обладающие этими свойствами.
12.9. СПИРТООБРАЗУЮЩАЯ СПОСОБНОСТЬ. КРИВЫЕ БРОЖЕНИЯ
Спиртообразующую способность оценивают по максимальному количеству спирта, которое могут образовать расы при сбраживании высокосахаристого сусла.
Результат учитывается по максимальной спиртуозности бражки, полученной при использовании исследуемых дрожжей в сусле с достаточным содержанием сахара. Опыты проводятся в небольших склянках для брожения вместимостью 90 см3, содержащих 60 см3 сусла. В одной серии склянок ведут анаэробное брожение под стеклянной трубкой с оттянутым тонким концом, в другой – они закрыты простыми ватными пробками. Склянки оставляют на брожение в термостате при 25°С. Повторные взвешивания позволяют начертить кривые потерь массы.
По окончании брожения определяют содержание спирта пикнометрическим методом, флотационным методом или окислением спирта бихроматом.
Известно, что этиловый спирт действует токсично на все дрожжевые расы, но его ингибирующая концентрация варьирует в широком диапазоне. Присутствие в сусле незначительных количеств спирта оказывает слабое стимулирующее действие на размножение клеток. Но с увеличением концентрации спирта до 1,5–2,0% размножение клеток тормозится, а при 5,0% прекращается полностью. Токсические свойства этого соединения есть результат нарушения пористости и проницаемости клеточной мембраны, что, естественно, приводит к проблемам транспорта питательных веществ и дефициту доступной цитоплазме воды.
Сложность механизмов устойчивости дрожжевых клеток к этиловому спирту подтверждается и тем фактом, что выявлено более 250 генов, участвующих в этом процессе.
В большинстве случаев расы, обладающие высокой спиртообразующей способностью, являются и спиртоустойчивыми. Под спиртоустойчивостью следует понимать способность рас проявлять жизнедеятельность при высоких концентрациях спирта в среде.
Для определения спиртоустойчивости рас дрожжей готовят разводки исследуемых рас на стерильной среде, содержащей 10–11% спирта и 2% глюкозы при температуре 25°С. Через 5 суток разводку каждой расы дрожжей вносят в количестве 1% в пропастеризованную или автоклавированную среду, содержащую 15% спирта и 2% глюкозы. Посев выдерживают при температуре 25°С и отмечают, на какие сутки в среде дрожжи размножились и начали бродить. О положительном результате свидетельствуют помутнение среды и газообразование.
Наиболее спиртоустойчивыми являются расы дрожжей, ранее других размножившиеся и забродившие в среде с 15% спирта, наименее спиртоустойчивые расы в такой среде не размножаются и не бродят.
Опыты удобно ставить в пенициллиновых флаконах, закрытых резиновыми пробками.
12.10.2. МЕТОД СЕРИЙНЫХ РАЗВЕДЕНИЙ***
Инкубирование чистой культуры исследуемой расы дрожжей проводится в приборе, представляющем собой стеклянную бутылку с герметично закрывающейся трехходовой крышкой, исключающей испарение спирта при брожении. В сосуд наливается жидкая питательная среда и помещается стеклянный поплавок для последующей регистрации газообразования. Поплавок заполняется жидкой средой, прибор закрывается пробкой через марлевую салфетку и автоклавируется при 0,1 МПа в течение 20 мин.
В качестве субстрата используется глюкозно-дрожжевая среда, содержащая 5% глюкозы и 0,3% дрожжевого автолизата.
Далее в остывшую до комнатной температуры среду внести суточную сусло-культуру исследуемых дрожжей и этиловый спирт. Количество спирта должно соответствовать серии разведений от 10,0 до 14,0% и более (при необходимости) с шагом 0,5%. В контрольную пробу спирт не вносить.
Жидкая питательная среда, дрожжевая взвесь и этиловый спирт дозируются точно в соответствии с произведенными расчетами заданной концентрации спирта.
После составления питательной среды бутылки плотно закрыть и для исключения ошибки дополнительно покрыть резиновыми колпачками.
Инокулированные дрожжевой взвесью спиртосодержащие среды поместить в термостат при 30°С и инкубировать в течение 72 ч, регистрируя результаты каждые 24 ч.
Результаты брожения учитывать по четырехкрестной системе, регистрируя объем жидкости, вытесненной из поплавка углекислым газом.
Показателем спиртоустойчивости считать наибольшую концентрацию спирта, при которой еще регистрируются признаки брожения.
Для подтверждения результатов бродильной пробы по истечении 72 ч инкубации производятся посевы на сусло-агар из образцов с минимальным отрицательным результатом и выше.
Высокие концентрации этилового спирта в среде могут оказывать на дрожжевую клетку микостатическое действие, приводящее к остановке метаболических реакций брожения, но не к гибели клетки. Микоцидные концентрации этилового спирта превышают концентрации микостатические.
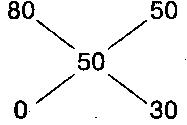
Правило креста. Правило смешивания растворов для получения заданной концентрации. Для получения раствора заданной концентрации из двух растворов пользуются следующей схемой:
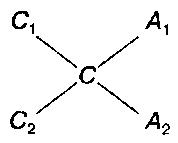
A1 = C – C2
A2 = C1 – C
где С – необходимая концентрация смеси, С1 – концентрация раствора и A1 – весовые количества раствора более высокой концентрации, С2 – концентрация раствора и A2 – весовое количество раствора более низкой концентрации.
П р и м е р. Из спирта крепостью 80% необходимо получить 50%-ный спирт. Как видно из схемы, для этого к 50 весовым частям 80%-ного спирта прибавляют 30 весовых частей воды.
В годы, неблагоприятные для вызревания винограда, отдельные его партии могут поступать на переработку при величине рН сусла 2,5–2,9. Имеются наблюдения, что не все расы дрожжей могут полностью сбродить сахар в сусле с такой низкой кислотностью. Чтобы получить полностью выброженные высококислотные виноматериалы, рекомендуется применять кислотоустойчивые расы дрожжей.
Кроме того, одним из технологических приемов, предупреждающих инфицирование субстрата посторонней микрофлорой, является подкисление среды органическими или неорганическими кислотами. Важным при этом является использование рас, сохраняющих свои технологические свойства в кислой среде.
Нижняя граница рН устанавливается в соответствии с отраслевыми и технологическими особенностями.
Для отбора кислотоустойчивых культур для виноделия необходимо определять их бродильную способность в сусле с величиной рН 2,6 и содержанием сахаров 18% при температуре 25–27°С. При отсутствии в лаборатории сусла с такими кондициями его можно получить подкислением 10%-ным раствором винной кислоты и разбавлением водой обычного сусла с более высокой концентрацией сахаров и меньшей кислотностью.
Отбирают те расы дрожжей, которые начинают размножаться и сбраживают сусло быстрее и полнее других. В конце брожения необходимо определить остаточные сахара, чтобы убедиться в полном выбраживании их в сусле с рН 2,6 отобранной культурой.
Методика постановки опытов и контроль за ходом брожения описаны в п. 13.2.
Изменив сбраживаемый субстрат, температурный режим инкубации и величину рН, описанный метод можно применить для исследования кислотоустойчивости дрожжей, используемых в других отраслях промышленности.
Та6лица 18
Предельно допустимые концентрации кислот для пивных дрожжей
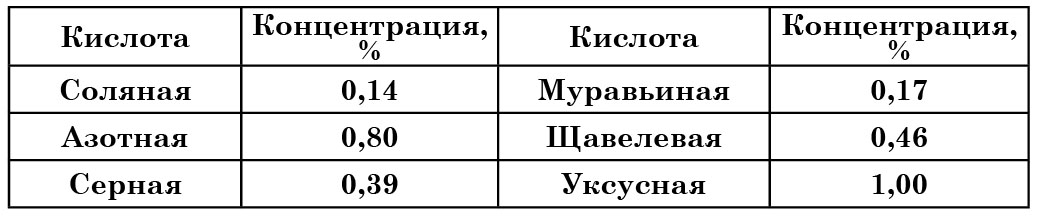
Установлено, например, что через 24 ч пивные дрожжи погибают при концентрациях кислот, указанных в таблице 18.
Большое значение имеет способность дрожжей к оседанию, во многом определяемая их флокуляционной способностью. От этого свойства дрожжей зависят степень сбраживания, осветление продукта, редукция диацетила и т. д.
Способность дрожжей к флокуляции определяют по скорости оседания и величине осадка за определенный период.
12.12.1. ОПРЕДЕЛЕНИЕ ФЛОКУЛЯЦИОННОЙ СПОСОБНОСТИ
Метод ЧССР. Производственные семенные дрожжи, содержащие 3 г сухого вещества, смывают физиологическим раствором (0,85%-ный раствор поваренной соли) в мерный цилиндр вместимостью 500 см3 и диаметром 5 см и доливают до объема 400 см3. После взбалтывания в течение 1 мин цилиндр оставляют в покое и через 12 мин определяют объем осевших дрожжей. Хорошие хлопьевидные дрожжи за это время образуют осадок высотой не менее 28 мм.
Метод Варна. Дрожжи промывают водой и отпрессовывают на воронке, затем 5 г их переносят в колбу со 100 см3 дистиллированной воды и перемешивают. Затем 10 см3 суспензии переносят в градуированную центрифужную пробирку, добавляют 1 см3 уксуснокислого Na-ацетатного буферного раствора с рН 4,5, встряхивают до получения равномерной взвеси и оставляют в покое. Через 10 мин отмечают объем осадка дрожжей. Если объем осадка больше 5 см3, дрожжи хорошо флокулируют, если объем осадка меньше 5 см3, дрожжи флокулируют слабо.
Метод Хельма. Метод состоит в том, что дрожжи промывают водой и отпрессовывают на воронке, отбирают 1 г и переносят в градуированную центрифужную пробирку вместимостью 15 см3. Затем в эту пробирку добавляют 10 см3 ацетатного буферного раствора, в 1000 см3 которого содержится 0,51 г сульфата кальция, 6,8 г ацетата натрия и 4,05 г ледяной уксусной кислоты при рН 4,5. Дрожжи при центрифугировании хорошо промывают раствором, после чего суспензию выдерживают на водяной бане 20 мин при температуре 20°С. Затем содержимое пробирки тщательно взбалтывают до получения равномерной взвеси и оставляют в покое, отмечая величину осадка через равные промежутки времени.
Метод позволяет выявить различия между хлопьевидными и пылевидными дрожжами.
Суспензия хлопьевидных дрожжей быстро разделяется на два слоя и уже через 10 мин образуется осадок, который постепенно уменьшается благодаря уплотнению. У пылевидных дрожжей осадок образуется лишь через 30 мин и со временем увеличивается за счет дополнительного оседания взвешенных клеток (рис. 33).
Метод Иошида. Дрожжи из расчета 2–3 млн клеток в 1 см3 вносят в 250 см3 пивного сусла с концентрацией сухих веществ 8% и культивируют 2 суток при 25°С.
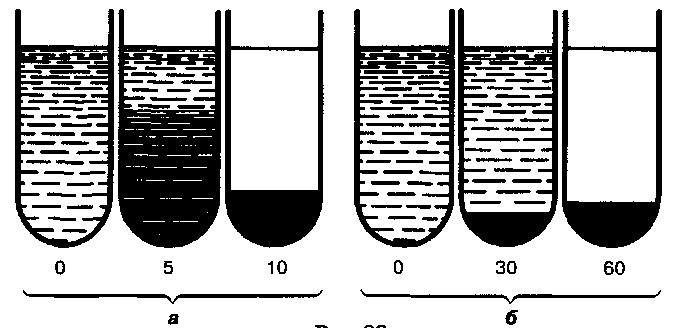
Рис. 33
Характер образования осадка у дрожжей:
а – хлопьевидных; б – пылевидных.
Сбраживаемое сусло тщательно перемешивают и по 10 см3 вносят в бутылки диаметром 6 см, содержащие по 190 см3 стерильного охмеленного сусла. Культивирование проводят при 11°С. Каждые сутки в бутылках измеряют оптическую плотность сбраживаемой жидкости на глубине 3 см от поверхности при λ = 630 нм и видимый или действительный экстракт.
Строят график: по оси ординат откладывают оптическую плотность, а по оси абсцисс – видимый или действительный экстракт. Полученная кривая характеризует флокуляционную способность дрожжей.
С точки зрения технологии следует обратить внимание на следующие параметры, характеризующие специфику процесса флокуляции:
- интенсивность;
- время наступления;
- скорость образования хлопьев;
- тип хлопьеобразования;
- оптимальные условия среды (температура, состав и т. д.).
По способности флокулировать пивные дрожжи сгруппированы в четыре класса:
- Пылевидные дрожжи. Эти дрожжи диспергированы в бродящем сусле в течение всего брожения. В стационарной фазе они образуют скопления, состоящие из 10 и менее клеток.
- Флокулирующие дрожжи первого класса. Большую часть периода брожения клетки остаются во взвешенном состоянии. После сбраживания 2/3 экстракта клетки начинают флокулировать с образованием хлопьев, состоящих из 1000 и менее клеток. Осадок дрожжей имеет плотную консистенцию со слегка размытой поверхностью.
- Флокулирующие дрожжи второго класса. Процесс флокуляции начинается после сбраживания 2/3 экстракта. Хлопья содержат до многих тысяч клеток. Осадок имеет плотную консистенцию.
- Флокулирующие дрожжи третьего класса. Процесс флокуляции начинается на ранних стадиях брожения.
Для производства пива низового брожения или лагерного пива используют штаммы дрожжей, относящиеся к 1-му и 2-му классу флокулирующих дрожжей. Способность дрожжей к флокуляции определяют любым из вышеперечисленных методов. Согласно методу Хельма, хорошо флокулирующие дрожжи полностью оседают в растворе ацетатного буфера через 10 мин, в то время как пылевидные дрожжи – через 60 мин. При использовании метода, предложенного чешскими специалистами, дрожжи, имеющие высокую флокуляционную способность, образуют осадок высотой 25–36 мм в стандартном объеме физиологического раствора в течение 12 мин.
Образование мицелия и псевдомицелия изучают на кукурузном или картофельно-глюкозном агаре методом пластинок, или культур на стекле (slide-culture).
Кукурузный агар. 12,5 г кукурузной муки в 300 см3 водопроводной воды нагревают на водяной бане при 60°С в течение 1 ч, затем фильтруют через бумажный фильтр. Объем фильтрата доводят до 300 см3, добавляют 3,8 г агара и автоклавируют 15 мин при 121°С. Горячую среду еще раз фильтруют через вату, разливают по пробиркам и снова стерилизуют при том же режиме.
Картофельно-глюкозный агар. 100 г промытого, очищенного и измельченного картофеля вымывают в 300 см3 водопроводной воды в течение нескольких часов на холоде. Массу фильтруют через ткань и автоклавируют в течение 1 ч при 121°С. Для приготовления агаровой среды к 230 см3 этой жидкости добавляют 770 см3 водопроводной воды, 20 г глюкозы и 20 г агара и стерилизуют в автоклаве 15 мин при 112°С.
Приготовление препаратов. Расплавленную среду наливают в чашки Петри и в нее, зажав пинцетом, опускают и быстро вынимают стерильные предметные стекла. Покрытые пленкой агара стекла помещают на U-образную стеклянную подставку в другой чашке Петри и оставляют до полного застывания среды.
Посевы делают тонкими штрихами – по три на каждой пластинке параллельно короткой стороне стекла или по одному вдоль длинной стороны стекла. Стерильные покровные стекла накладывают на штрихи так, чтобы под ними не было пузырьков воздуха и чтобы часть штриха осталась непокрытой. На дно чашки наливают стерильную воду во избежание пересыхания слоя агара на пластинке.
Через 6–8 дней инкубации при 25°С стекла вынимают и, предварительно очистив их нижнюю поверхность от агара, помещают на столик микроскопа для наблюдений. На таких препаратах не нарушается естественное расположение клеток псевдомицелия, бластоспор или артроспор.
Образование мицелия и псевдомицелия наблюдают в анаэробных (под покровным стеклом) и в аэробных (вне стекла) условиях.
Так как на практике зачастую бывает трудно отличить ложный мицелий от истинного, особенно в культурах, где есть и почкование, и деление, то следует обращать внимание на следующее (рис. 34):

Рис. 34
Различия между истинным (а) и ложным (б) мицелием
- граница между клетками истинного мицелия – резко преломляющая свет прямая перегородка; граница между клетками ложного мицелия представлена их изогнутыми концами и не отличается по преломлению света от боковых стенок гиф;
- в истинных гифах концевые клетки обычно более длинные, чем предшествующие, а в нитях псевдомицелия – наоборот;
- у истинного мицелия нет перетяжек в зоне перегородок, а на псевдомицелии эти перетяжки хорошо заметны.
12.14. ОПРЕДЕЛЕНИЕ ФЕНОТИПОВ: КИЛЛЕР, НЕЙТРАЛЬНЫЙ, ЧУВСТВИТЕЛЬНЫЙ
При описании различий между расами дрожжей сообщается о том, что все дрожжи Saccharomyces принадлежат к одному из трех фенотипов: киллер (К), нейтральный (N) или чувствительный (S).
Применение рас дрожжей определенных фенотипов (К, N или S) позволяет проконтролировать, в какой степени чистая культура, внесенная в нестерильное сусло, способна овладеть средой. Для этого необходимо определить процентное содержание дрожжей фенотипов K, N, S в спонтанно сбраживаемом сусле (контроль) и в отстоянном сусле, забродившем при внесении в него разводки чистой культуры дрожжей определенного фенотипа.
Техника определения фенотипов K, N, S состоит в следующем.
В чашки Петри разливают агаризованное (1,5%) виноградное сусло за 2–3 суток до использования, чтобы оно слегка подсохло и затем хорошо впитывало нанесенные на него дрожжевые суспензии.
Высушивать лучше в стерильном боксе под УФ-лампой в течение 3–5 ч, поставив перевернутое дно чашки на ребро ее крышки.***
При работе на виноградном сусле для предотвращения гидролиза агара его 3%-ный водный раствор стерилизуют отдельно от сусла и смешивают при температуре 60–70°С в равных количествах.
Для лучшей контрастности зон подавления роста чувствительных культур в расплавленную среду можно добавлять перед розливом в чашки Петри стерильный 0,5%-ный водный раствор метиленового синего в количестве 1 см3 на 200 см3 среды.
Отдельную колонию штамма дрожжей, фенотип которого необходимо определить, изолируют иглой с плотной питательной среды и примерно в равном соотношении переносят на внутреннюю стенку пробирки с 0,5 см3 стерильной водопроводной воды и уколом на чашку Петри с газоном культуры фенотипа S.
На одну чашку можно нанести в определенной последовательности до 30 уколов исследуемых штаммов.
Стерильно готовят водные суспензии тех же колоний в пробирках с 0,5 см3 водопроводной воды и на других чашках Петри с сусло-агаром (без газона штамма фенотипа S). Делают петлей газоны исследуемых штаммов дрожжей диаметром около 1,5 см. На них в центр наносят уколом штамм фенотипа К, предварительно выращенный на сусло-агаре. На одну чашку можно нанести газоны десяти исследуемых штаммов в той же последовательности, что и на газоне штамма фенотипа S. Через 2 суток инкубации чашек Петри с посевами при температуре 25– 28°С определяют фенотипы штаммов.
Если вокруг колоний образовались зоны на газоне чувствительного штамма, то штаммы идентифицируются как киллеры. Штаммы, на газонах которых киллер образует зоны, являются чувствительными, остальные – нейтральными.
В качестве тестеров (индикаторных культур) можно использовать киллер и чувствительные расы коллекционных культур S. vini.







