Химический состав микробов сложен и разнообразен. В них содержатся белки, углеводы, липиды, витамины, ферменты и другие вещества.
Элементарной основой органических и минеральных веществ микробной клетки являются водород, кислород, азот. Важное значение имеют также железо, фосфор, калий, натрий, кальций, магний, марганец и другие элементы.
Вода составляет основную массу микроорганизмов тела. Количество ее колеблется в вегетативных клетках микробов от 75 до 85%, в спорах воды значительно меньше— около 50%. Содержание воды в теле различных микробов неодинаково: оно меняется в зависимости от вида, возраста, питания, состава среды обитания. В воде растворены все наиболее важные органические и минеральные вещества микробной клетки. В водной среде протекают основные биохимические процессы, вызываемые микробами, например гидролиз углеводов, белков и других веществ.
Белки — основа всех жизненных структур микроорганизмов. Наличие в белках большого количества химических функциональных групп и своеобразие строения молекул белков определяют видовые и специфические признаки микробов.
«Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка»,— писал Ф. Энгельс.
Белки входят в состав цитоплазмы, ядра, оболочек и прочих структур клетки. Белки микроорганизмов, как и все прочие, представляют собой полипептидную цепочку, построенную из разнообразных аминокислот.
Аминокислоты, поступающие в процессе питания в клетки микробов, в основном используются на пластические цели, т. е. для синтеза белков самой клетки. Лишь в некоторых случаях белки и аминокислоты могут служить энергетическим материалом или откладываться в качестве запасных веществ в цитоплазме клеток (зерна волютина).
Сухой остаток (т. е. то, что остается после высушивания клеток микробов) примерно на 80 % состоит из белков.
Различают белки простые и сложные; в состав последних входят и небелковые группы (углеводы, жиры, пигменты, нуклеиновые кислоты). . Большое значение для жизнедеятельности микроорганизмов имеют входящие в состав каждой клетки особые белковые вещества (ферменты, которые будут рассмотрены особо).
Нуклеиновые кислоты — сложные вещества, участвующие в регулировании синтеза клеточных белков, передаче наследственной информации и других процессах. Их доля в расчете на сухое вещество составляет 10—30 %. Известны несколько типов рибонуклеиновой кислоты: рибосомная (р. РНК), транспортная (т. РНК), матричная (м. РНК). Рибосомная входит в состав рибосом, транспортная переносит аминокислоты к рибосомам, матричная обеспечивает последовательность включения различных аминокислот в молекулы белка.
РНК состоит из азотистых оснований (аденина, гуанина, цитозина, урацила), углевода (рибозы) и фосфорной кислоты.
Близкое к РНК соединение ДНК отличается лишь тем, что вместо урацила в его структуре имеется тимин, а углевод представлен своей окисленной формой— дезоксирибозой.
Углеводы — содержатся в клетках микроорганизмов в количестве 10—60 % к сухой массе. Больше всего их в плесневых грибах и дрожжах. Углеводы входят в состав оболочек и слизистых капсул, сложных клеточных белков. Поступающие из окружающей среды углеводы используются как энергетический материал, а также служат для синтеза жиров и белков. Могут откладываться и в клетках в качестве запасных питательных веществ — в виде зерен гликогена.
В клетках микроорганизмов встречаются как простые (пентозы, гексозы, маннит, рибоза), так и сложные углеводы (крахмал, гликоген, клетчатка).
Жиры и жироподобные вещества содержатся в небольших количествах. Они входят в состав цитоплазмы, ядра, образуя с белками сложные соединения. Повышенное количество их находится в оболочках спор. Жиры также служат энергетическим материалом. Многие микроорганизмы накапливают жиры в качестве запасных питательных веществ (от 2 до 40 % к сухой массе).
Минеральные вещества играют важную роль в построении сложных белков, витаминов, ферментов, фосфорорганических и других веществ, входящих в состав микробных клеток. Растворы минеральных веществ поддерживают нормальный уровень внутриклеточного осмотического давления. В наибольших количествах в теле микроорганизмов имеются фосфор, калий, натрий, железо, сера, магний. Их содержится от 3 до 1,5 % к сухой массе.
Ферменты — вещества, способные каталитически влиять на скорость биохимических реакций. Они играют важную роль в жизнедеятельности микроорганизмов. Открыты ферменты в 1814 г. русским академиком К. С. Кирхгофом.
Как и другие катализаторы, ферменты в реакциях превращения веществ принимают участие лишь в качестве посредников. Количественно в реакциях они не расходуются.
Микробы содержат различные ферменты. Это связано с большим разнообразием условий, в которых они обитают. Различные микроорганизмы прошли неодинаковый эволюционный путь развития, чем и объясняется большое разнообразие их биохимической активности.
Разнообразные ферменты обеспечивают быстрое протекание в организме или вне его огромного количества реакций.
Академик И. П. Павлов оценивал роль ферментов как истинных двигателей всех жизненных процессов.
В процессе питания микробы, как правило, используют вещества, находящиеся в виде водных растворов. Перевод нерастворимых веществ пищи в растворимые и подготовленные для усвоения осуществляется с помощью ферментов, вырабатываемых микроорганизмами и выделяемых ими в окружающую среду. Ферменты, находящиеся в клетке, участвуют в синтезе веществ, в окислительно-восстановительных реакциях и других процессах.
По химической природе ферменты бывают однокомпонентными, состоящими только из белка, и двух-компонентными, состоящими из белковой и небелковой частей. Небелковая часть (простетическая группа) у ряда ферментов представлена тем или иным витамином.
Ферменты, как и белки, имеют большую молекулярную массу. Так, молекулярная масса пепсина составляет 36000, каталазы — 248000. Молекулярная активность, или так называемое число оборотов, т. е. число молекул субстрата, подвергаемых превращению в течение 1 мин одной молекулой фермента, неодинакова у разных ферментов, но у всех чрезвычайно велика. Например, фермент, катализирующий превращение при спиртовом брожении уксусного альдегида в спирт (алкогольдегидрогеназа), имеет молекулярную активность 4700, катализирующий перенос остатков фосфорной кислоты (фосфорилаза),— 40000, катализирующий взаимные превращения фосфодиоксиацетона и трифосфороглицеринового альдегида при спиртовом брожении (изомераза), — 500000.
Как видно, ферменты имеют исключительно высокую каталитическую активность, превышающую во много раз активность минеральных катализаторов. Так, одна часть химозина (сычужного фермента) может вызвать свертывание 12 млн. частей молока; 1 г фермента амилазы при благоприятных условиях может превратить в сахар 1 т крахмала.
Ионы железа каталитически ускоряют разложение перекиси водорода на кислород и воду. Каталитическое действие железа многократно возрастает, если оно входит в состав ферментов. Так 1 мг железа в составе фермента каталазы эквивалентен по каталитическому действию 10 т неорганического железа.
Каждый фермент обладает строгой специфичностью действия, т. е. способностью влиять только на определенные связи в сложных молекулах или лишь на определенные вещества. Например, мальтаза расщепляет только мальтозу, лактаза — только лактозу, а амилаза способна вызвать распад только крахмала.
Ферменты неустойчивы к действию высокой и низкой температуры, существенному подкислению или подщелачиванию, изменению концентрации солей, радиации и др. Это свойство обусловлено белковой природой ферментов.
При повышении температуры до 40-50 °С скорость ферментативных реакций возрастает на каждые 10 °С примерно в 2-3 раза. При дальнейшем повышении температуры многие ферменты начинают разрушаться и теряют в связи с этим свою активность (инактивируются). Чем выше температура, тем быстрее происходит инактивирование фермента. Однако многие ферменты сохраняют активность и при 70 °С. При температуре выше 80 °С практически все ферменты необратимо инактивируются. Сухие ферменты более устойчивы: некоторые переносят нагрев до 100°С в течение нескольких часов.
Температура, при которой практическая скорость реакции наибольшая, называется оптимальной. Для большинства ферментов она составляет 30-40 °С. Понижение температуры ниже оптимальной приводит к замедлению действия ферментов. Особенно заметно это сказывается при температуре ниже 0°С, хотя разрушение ферментов не происходит.
На ферментативные процессы существенно влияет активная реакция среды. Для одних ферментов наилучшей является кислая среда, для других — нейтральная или слабощелочная.
Изменение реакции среды за пределы оптимального значения приводит к существенному снижению скорости катализируемого процесса и в конечном счете к полной потере активности фермента. Установлено, что изменение кислотности среды приводит к потере электрического заряда белковыми компонентами ферментов, поэтому они теряют растворимость и осаждаются. Исчезает также возможность контакта ферментов с субстратом, и ферментативные реакции прекращаются. Происходит это в так называемой изоэлектрической точке, которая для каталазы совпадает со значением кислотности, равным 5,0 рН, для трипсина— 7,0-8,0 рН.
На скорости ферментативных процессов отражаются концентрация субстрата, на который действует фермент, и концентрация самого фермента. При малых концентрациях субстрата, когда фермент оказывается в избытке, скорость ферментативной реакции относительно снижается; практическая скорость реакции уменьшается при избытке субстрата.
Химические вещества могут оказывать на ферменты как активизирующее, так и инактивирующее действие. Например, соли тяжелых металлов (меди, никеля, серебра, свинца, ртути), даже в малых дозах, инактивируют действие ферментов, а в более значительных — разрушают их. Соли же некоторых щелочноземельных металлов в малых дозах активизируют действие ферментов. Фенол и хлороформ, убивающие микроорганизмы, оказывают парализующее действие и на ферменты. Сами ферменты могут иногда подвергаться разрушительному действию других ферментов. Необратимо инактивируют ферменты при действии больших доз ультрафиолетового или радиоактивного облучения.
Ферменты, выделяемые живыми клетками наружу и служащие для внеклеточной переработки пищи, называют экзоферментами; ферменты, не выделяющиеся при жизни клетки в окружающую среду, а участвующие только во внутриклеточных процессах, — эндоферментами.
Микробы, попадая в необычные условия обитания, сравнительно легко к ним приспосабливаются. При этом изменяется потребность в ферментах, и микробы в некоторых случаях оказываются способными продуцировать необходимые именно в этих условиях ферменты. Их называют адаптивными в отличие от конститутивных, которые постоянно имеются в клетках данного организма.
В настоящее время выделено около 1000 ферментов. По общности или близости каталитических свойств в соответствии с современной классификацией, предложенной специальной комиссией Международного биохимического союза 1961 г., ферменты делят на шесть классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы). Каждый класс подразделяют на группы, а группы — на подгруппы.
Ниже дается характеристика классов ферментов.
Оксидоредуктазы — окислительно-восстановительные ферменты. Принимают участие в процессах дыхания, брожения, ускоряя процесс переноса атомов водорода от одного вещества к другому.
Трансферазы катализируют реакции переноса групп атомов от одного соединения к другому. Например, фосфоферазы переносят остаток фосфорной кислоты при спиртовом брожении, аминоферазы переносят аминогруппы от аминокислот к другим веществам.
Гидролазы катализируют многочисленные реакции, идущие с присоединением или отнятием воды. Примерами могут являться сахараза, мальтаза (ферменты, расщепляющие сахара, и др.).
Лиазы катализируют превращение веществ с разрывом связей между атомами углерода, углерода и кислорода.
Например, альдолаза катализирует распад 1,6 дифосфатфруктозы на 3 фосфороглицериновый альдегид и фосфодиоксиацетон при спиртовом, молочно-кислом и других брожениях.
Изомеразы катализируют взаимное превращение изомеров. Например, триозофосфатизомераза катализирует взаимные превращения фосфодиоксиацетона и 3 фосфороглицеринового альдегида в типичных брожениях.
Лигазы (синтетазы) катализируют реакции соединения молекул, сопровождающиеся распадом аденозинтрифосфорной кислоты (АТФ).
Каждый класс, группа и подгруппа имеют свой шифр — номер, а каждый фермент в подгруппе — свой порядковый номер. Таким образом, наименование каждого фермента и его свойства могут быть выражены цифровым шифром. Словесное наименование конкретных ферментов слагается из названия субстрата, на который действует фермент, и типа вызываемой реакции. Если же фермент переносит какие-либо химические группы к другому субстрату, то в наименование включается и название этого субстрата. Так, фермент уреаза, ускоряющий реакцию расщепления мочевины на углекислый газ и аммиак, по этой номенклатуре должен называться карбамидамидогидролазой в связи c катализируемой реакцией:
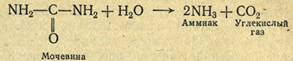
Наименование этого же фермента в виде шифра 8.5.1.5 (класс 3, группа 5, подгруппа 1 и порядковый номер 5).
В связи со сложностью построения наименований ферментов по новой классификации наряду с новыми допускаются старые наименования, учитывающие лишь некоторые свойства ферментов (пепсин в переводе с греческого — пищеварение, трипсин — разжижение, папайи — от названия дынного дерева, из которого фермент получен). Старые наименования некоторых ферментов состоят из слова, обозначающего субстрат, и окончания «аза»: амилаза (действует на крахмал), протеаза (действует на белки), липаза (действует на жиры) и т. д.







