Гидролазы являются важнейшими ферментами молока. Они катализируют гидролитическое расщепление основных его компонентов – липидов, углеводов и белков. Изменяя качественно и количественно химический состав молока, гидролазы способствуют изменению некоторых физико-химических свойств и ухудшению его органолептических показателей. Из гидролаз в молоке обнаружено ≈ 65 эстераз, гликозидаз, протеаз и других.
Эстеразы. Эстеразы действуют на сложноэфирные связи различных эфиров. В молоке обнаружены активности некоторых гидролаз эфиров карбоновых кислот, гидролаз фосфомоноэфиров и фосфодиэфиров. К гидролазам эфиров карбоновых кислот относятся карбоксил-, арил-, холин- и ацетилхолинэстеразы, липазы и некоторые фосфолипазы.
Карбоксилэстераза (3.1.1.1)[1] (эстераза Б), обнаруженная в молоке, имеет нативное и микробное происхождения. Так, карбоксилэстеразная активность выявлена у многих штаммов бактерий рода Micrococcus и дрожжей, выделенных из сырого молока. Полагают, что нативный фермент в основном сконцентрирован в водной фазе молока. Из молока карбоксилэстераза выделена довольно в чистой форме (Montgomery М. W., Forster Т. L.). Фермент катализирует гидролиз алифатических и ароматических эфиров карбоновых кислот:
![]()
т. е. имеет достаточно широкую субстратную специфичность. При этом гидролазы эфиров карбоновых кислот в отличие от ди- и триацилглицерол-липаз предпочитает быстрее катализировать растворимые, чем субстраты в эмульсионной форме (Kitchen В. J., 1985). По специфичности к гидролизу триглицеридов карбоксилэстераза идентична триацилглицерол-липазе молока, рассматриваемой далее.
Арилэстераза (3.1.1.2) (эстераза А), попадает в молоко из крови, плазма которой содержит ее в 1000...2000 раз больше, чем молоко, и, видимо, является только нативным ферментом. Имеются данные о подобности молочной и арилэстеразы из крови – по молекулярной массе, активаторам и ингибиторам. Полагают, что арилэстераза содержит ЛПВП и что она является активатором любого липолиза. Этот фермент выделен из молока, частично очищен и имеет молекулярную массу от 50 000 до 70 000 Да.
Арилэстераза катализирует гидролиз многих ароматических эфиров карбоновых кислот, например:
![]()
а также некоторых органических фосфатов, т. е. имеет широкую субстратную специфичность.
Впервые наличие арилэстеразы А в молоке установили в 1901 г., а в 1959 т. Forster Т. L., Bendixen Н. A., Montgomery М. W. сообщили о наличии в молоке арил- и холинэстераз.
Холинэстераза (3.1.1.8) (эстераза С) – этот нативный фермент (считают, что ее источником служат лейкоциты) выделен из молока. В активном центре молекулы холинэстеразы имеется реакционноспособный серин, который обусловливает каталитическую активность фермента. Холинэстераза катализирует в основном гидролиз различных эфиров холина:
![]()
Ацетилхолинэстераза (3.1.1.7) – нативный фермент молока. Считают, что ее источником в молоке является эндоплазматический ретикулум секреторных клеток молочной железы. Обнаружен он в микросомах ОШЖ и действует на различные эфиры уксусной кислоты, проявляя особую специфичность к ацетилхолину:
![]()
По сравнению с карбоксил- и арилэстеразами субстратная специфичность ацетилхолинэстеразы и холинэстеразы менее широкая. Оптимальные условия для проявления их активности следующие: температура ≈ 37 °С и рН 7,0...8,0.
В отношении содержания карбоксил-, арил-, холин- и ацетилхолин-эстераз в коровьем молоке данные противоречивы. Одни исследователи считают, что в молоке преобладает карбоксилэстераза – около 60 %, а другие, наоборот, что арилэстераза – около 80 % от общего содержания указанных эстераз (по Kitchen В. J., 1985). Показано, что карбоксил-, арил- и холинэстеразы находятся в обезжиренной фракции молока и активность каждой из них составляет более 0,15 Е/мл (≈ 2,5 нкат) (по Grün E., 1985). По данным Forster Т. L., Montgomery М. W., Montoure J. Е., активность этих ферментов в свежевыдоенном молоке составляет соответственно 237,66 и 24 ед. (1 ед. – это количество фермента, которое катализирует выделение 1 мл CO2/мл молока в течение 30 мин). Считают, что меньшая активность холинэстеразы в молоке обусловливается наличием ингибиторов, которые блокируют этот фермент. Такими ингибиторами могут быть водорастворимые фосфорорганические соединения, в частности пестициды.
Карбоксил- и холинэстеразы играют незначительную роль в липолизе молока. О практическом значении арил- и холинэстераз для молочной промышленности см. п. 2.4.
Триацилглицерол-липаза (3.1.1.3) (липаза). Первое сообщение об этой липазе появилось в 1922 г. Основными источниками нативной триацилглицерол-липазы в молоке являются плазма крови и лизосомы секреторных клеток молочной железы. Некоторые липазы попадают в молоко через кровь из поджелудочной железы, т. е. имеют другое тканевое происхождение и, поступая в молочную железу из плазмы крови, участвуют в синтезе глицеридов молока.
Липазы микроорганизмов, как правило, являются внеклеточными ферментами. Они катализируют гидролиз глицеридов, при котором высвобождаются свободные жирные кислоты, необходимые клетке. Наиболее выраженной липолитической активностью обладают психрофильные бактерии родов Pseudomonas, Achromobacter, Alcaligenes и Flavobacterium, что особенно следует учитывать в случае длительного хранения сырого молока на фермах при относительно низких температурах. Они хорошо развиваются при температуре ≤7°С (оптимальная температура их роста ≈ 20 °С).
Так, например, количество липазы, продуцируемой Pseudomonas fluorescens в цельном молоке при 4°С примерно на 25 % больше, чем при 10 °С. Показано, что молекула липазы этого микроорганизма не содержит ни углеводов, ни липидных остатков. Молекулярная масса фермента составляет 33 000 Да и имеет изоточку при pH 4,46. Фермент ингибируется многими тяжелыми металлами и несколько активируется кальцием или магнием. Возможно, что кальций является акцептором освобождающихся СЖК. Большая часть бактериальных липаз имеют нейтральный или слабо щелочной оптимум рН. Так, липазы Achromobacter lipolyticum имеют оптимум рН 7,0. Оптимальная величина рН зависит от природы субстрата и условий опыта (по Driessen F. M., 1989).
При неудовлетворительных условиях получения молока на фермах или недостаточном его охлаждении психрофильные бактерии могут составлять 50 % и более общего количества бактерий в молоке. Однако липолитические ферменты этих бактерий являются первопричиной липолиза только в том случае, когда их содержание в 1 мл молока ≥106..107 клеток. Результаты исследований показывают, что при таком содержании живых клеток Ps. fluorescens их липолитическая активность достигает 1,363 Е/мл (≈ 23 нкат) (Downey W. К., 1980).
Показано, что из 65 изученных штаммов психрофильных бактерий (Pseudomonas ≈ 40 %, Achromobacter ≈ 40 % и Alcaligenes ≈ 15 %) сырого охлажденного молока около 23 % обладали выраженной липолитической активностью (Моисеева Е. Л., 1988). Интенсивными липазообразователями являются также микроскопические грибы вида Penicillium, Aspergillus и Mucor, а среди дрожжей – Candida lypolytica, Oospora lactis и Candida currata.
Липолитическая активность молочнокислых бактерий незначительная по сравнению с другими липолитическими микроорганизмами и для молока не представляет особой опасности. Молочнокислые палочки по сравнению с молочнокислыми лактококками обладают более выраженной липолитической активностью (Королева Н. С). М. С. Уманский и Ю. А. Боровкова (1979) исследовали липолитическую активность мезофильных и термофильных молочнокислых бактерий. Степень этой активности определяли по увеличению содержания СЖК как основного продукта липолиза в результате 7-дневного культивирования штаммов в стерильном цельном молоке при оптимальной температуре по сравнению с количеством СЖК в исходном молоке. Абсолютное увеличение содержания СЖК на 4% и более свидетельствовало о высокой, на 2...3 % – о средней и менее чем на 1,5 % – о низкой липазной активности штамма. Наибольшее количество штаммов с высокой липолитической активностью было обнаружено у L. diacetilactis – 50 % и Lb. helveticus – 46,2 %. Низкая липолитическая активность была характерна для L. lactis и Str. thermophilus. З. X. Диланян с сотр. установили, что из стрептококков наибольшее количество ЛЖК образовывали Str. faecalis около 47 мг%, а наименьшее – Str. bovis – 2,7 мг% (в тех же условиях культивирования).
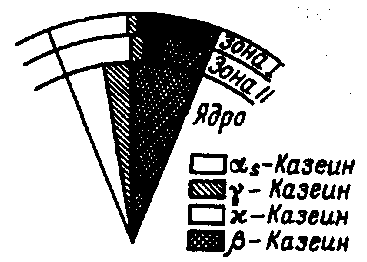
Рис. 14. Схематическое строение сегмента мицеллы казеина (по Тёпел А., 1979)
(компонентный состав поверхности зон (зона I): αS-казеин – 48 %,
к-казеин – 45 %; γ-казеин – 4 %; β-казеин – 4%)
Нативная липаза в молоке в основном связана с казеином. При этом она обнаружена главным образом в к-казеине и ничтожно мало – в β-казеине (рис. 14). Считают, что 80...90% нативной липазы молока связано с фракциями казеина и только около 10% – с иммуноглобулинами и ОШЖ молока (рис. 15). Существует два типа расположения липазы в мицеллах казеина: свободно связана с поверхностью мицеллы и прочно связана внутри мицеллы и, возможно, принимает участие в ее строении. Принято липазу, связанную с белками молока, называть плазменной, а связанную с ОШЖ – мембранной. В молоке различных коров соотношение между указанными видами липаз может несколько отличаться.
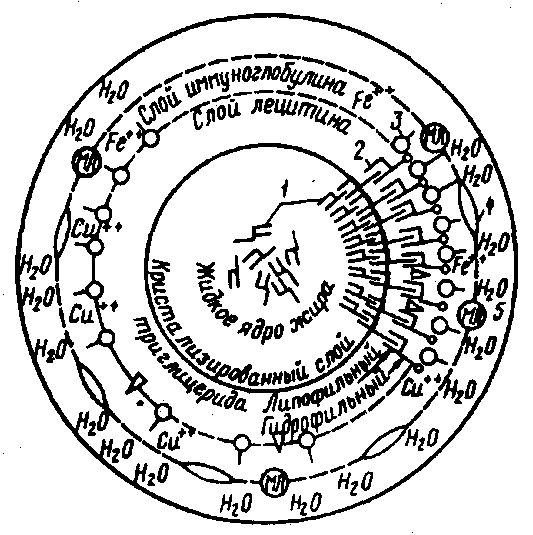
Рис. 15. Схематическое строение шарика жира и его оболочки (по Тёпел А., 1979):
1 – молекулы триглицеридов; 2 – молекулы фосфолипидов;
3 – молекулы иммуноглобулина; 4 – микросомы; 5 – мембранная липаза
Для молока характерна сложная липазная система нативного происхождения, состоящая из нескольких липаз с различной молекулярной массой. Выделенные из молока и очищенные нативные липазы имеют следующие молекулярные массы: 7000...10000, 35000, 62000, 66000, 74000, 75000, 112000, 150000, 210000 Да. Удельная активность липазы молока равна 12...15 Е/мг белка. Содержание липаз нативного происхождения в молоке составляет ≈ 0,5 мг%. Липазы представляют собой гликопротеины, содержащие аминосахара, моносахариды (глюкозу или галактозу), сиаловую кислоту (0,6%). В зависимости от молекулярной массы липаза содержит 14,3...14,8 % азота, 0,16…0,26 % фосфора, ≈ 1% серы. Нативные липазы молока относится к ферментам серин-гистидинового типа (в активный центр входят серин и гистидин).
Липазы некоторых микроорганизмов также выделены, очищены и охарактеризованы, многие из них относятся к гликопротеинам.
Липазы катализируют гидролиз триглицеридов с образованием диглицеридов, моноглицеридов и жирных кислот:

где R1, R2 и R3 – радикалы жирных кислот в триглицериде.
Большая специфичность нативных липаз по отношению к первичным и третичным эфирным связям глицеридов отличает их от других тканевых липаз. Это указывает на то, что некоторые липазы молока присущи только секреторным клеткам молочной железы. Липазы микроорганизмов более специфичны к первичным и вторичным эфирным связям глицеридов молока, и при этом высвобождаются или все, или только ненасыщенные жирные кислоты. Липазы молока более специфичны к триглицеридам, чем к ди- и моноглицеридам, и в основном катализируют гидролиз триглицеридов с короткими цепями жирных кислот, чем триглицеридов с длинной цепью жирных кислот, что объясняется их большей гидрофильностью. Эти триглицериды более легко диффундируют к участку, где происходит реакция (Брокерхоф X,, Дженсен Р., 1978).
Физико-химический характер реакций, катализируемых липолитическими ферментами, уникален. Поскольку липазы растворимы в воде, а их субстраты – липиды нерастворимы, реакции протекают на границе жир – вода, т. е. имеет место межфазная гетерогенная реакция, зависящая не только от концентрации субстрата, но и от степени дисперсности его поверхности. В этом состоит существенное отличие ферментативного гидролиза липидов от других видов гидролиза.
Оптимальными условиями для проявления активности нативных липаз молока являются рН 9...10 и температура 35...40°С. Однако липазы достаточно активны при рН 6,6...6,7, свойственном сырому молоку. Имеются нативные липазы, проявляющие активность при рН 5,4 (кислая липаза) и 6,3. Липазы микроорганизмов имеют в основном оптимум рН 8,0, и только для липаз микроскопических грибов характерен оптимум рН 5,5...7,0.
По данным многочисленных исследований, активность нативных липаз в коровьем молоке составляет в среднем 1 ед. при колебании от 0,1 до 2,1 ед. (1 ед. активности соответствует 1 мкэкв СЖК, образующихся при катализировании гидролиза субстрата липазами, содержащимися в 1 мл молока, в течение 1 мин при 37 °С и рН 8,4...8,8).
Установлено, что соли желчных кислот участвуют в процессе липолиза. Они стимулируют липолиз не путем непосредственного воздействия на фермент, а путем косвенного воздействия на поверхность раздела фаз жир – вода. В отсутствии солей желчных кислот СЖК скапливаются на поверхности раздела фаз жир – вода, что вызывает ее блокировку и замедляет или прекращает липолиз (Downey W. К., 1980).
Изучение свойств выделенной из молока и очищенной нативной липазы показало, что такие белки молока, как β-лактоглобулин и фракции α- и β-казеина ингибировали ее активность. к-Казеин, α-лактальбумин и иммуноглобулины активировали липазу лишь при невысоких концентрациях, в то время как их высокие концентрации ингибировали фермент. Ингибиторами липазы являются соли магния и натрия, кислород, тяжелые металлы, N-этилмалеинид, йода ацетат, перекись водорода, некоторые антибиотики (наличие антибиотиков в молоке снижает активность фермента на 9...50 %). Активность фермента снижается при добавлении лецитина или фосфатидилэтаноламина. Эти полярные вещества локализируются на поверхности раздела фаз. Для липолиза молока необходим кальций, так как он предотвращает связывание СЖК с поверхностью раздела фаз жир – вода, ведущее к ингибированию липолиза. Добавление глутатиона стимулирует действие липазы (Брокерхоф Х., Дженсен В., 1978; Shipe W. F., 1982; Уманский М.С., 2000).
Основным источником липопротеинлипазы (3.1.1.34) (диацилглицерол-липаза) в молоке является плазма крови. Липопротеинлипаза находится в жировых тканях, мускулах, легких и молочной железе организма животного. Ее активность, тесно связанная выделением триглицеридов этими тканями, управляется гормонами, в зависимости от специфических нужд ткани при изменении физиологического состояния и/или энергетических запасов животного. На примере жировой ткани и мускулов фермент синтезируется, вероятно, благодаря гликопротеинам клеточных мембран, откуда перемещается к центру физиологической активности – эндотелию кровеносных сосудов (по Chilliard Y., 1982). Кроме того, полагают, что она синтезируется и секреторными клетками молочной железы.
Значительная часть липопротеинлипазы в коровьем молоке связана с казеином – 75 % и эта связь, подобно нативной липазе молока, осуществляется в основном ионными силами, имеют место также гидрофобное, электростатическое и полианионное взаимодействия. Небольшое количество фермента – 2 % находится в ОШЖ молока и 23 % обнаруживается в молочной сыворотке (Anderson М., 1982; Hohe К. A,, Dimick P.S., Kilara A., 1985).
Липопротеинлипаза выделена из молока с достаточно высокой степенью чистоты. Удельная активность выделенного фермента составила ≈ 167 ед./мг белка (1 ед. соответствует количеству мкмоль СЖК, образующихся при гидролизе липидов в минуту). Многочисленные исследования показывают, что значительные колебания активности липопротеинлипазы в коровьем молоке, которые составляют от 4,0 до 17 Е/мл (от ≈ 67 до 284 нкат) при 37 °С и только некоторые – ≈ 1 Е/мл (≈ 16,7 нкат), указывают на различие условий проведения опытов (вид субстрата, условия гидролиза, чистота опытов) (по Grün Е., 1985). Содержание липопротеинлипазы в молоке составляет обычно 0,1...0,3 мг% (Olivecrona-Bengtsson G., 1984; Driessen F. М., 1986). При оптимальных условиях липолиза в молоке в результате активности липопротеинлипазы может образоваться около 2 мкмоль СЖК/мл/мин (по Kitchen В. J., 1985).
Нативная липопротеинлипаза представляет собой полипептид с молекулярной массой 100 000 Да, некоторые исследователи указывают на величины 62000...66000 Да (Suchren G. et al., 1981). Молекула фермента содержит около 8 % углеводов, в активном центре – серин и гистидин. Этот высокоповерхностно активный фермент с изоэлектрической точкой при pH ≈ 9,0 по структуре является димером. Липопротеинлипаза, выделенная с высокой степенью чистоты из Ps. aeruginosa, представляет собой комплекс с молекулярной массой более 1 000 000 Да, содержащий углеводы, нуклеотиды и липиды (в сумме ≈ 28%) и белок ≈ 72% (В. А. Яковлев, Т. П. Левчук, В. А. Вовк).
Иммунологические исследования свидетельствуют о большом сходстве в структурах нативных липазы и липопротеинлипазы. Доказана идентичность их гликопротеиновой природы. Однако эти ферменты имеют и некоторые различия. Так, только липопротеинлипаза не имеет низкомолекулярных форм (менее 50 000 Да).
Липопротеинлипаза катализирует те же реакции гидролиза глицеридов молока, что и липаза, но с преимущественной специфичностью к первичным эфирным связям. Фермент в большей степени катализирует гидролиз диглицеридов, чем триглицеридов и особенно глицеридов с длинными цепями жирных кислот. Обнаружено, что липопротеинлипаза из Ps. aeruginosa катализирует гидролиз как триглицеридов, так и лецитина.
Показано, что выделенная из сырого цельного молока липопротеинлипаза (с удельной активностью 0,68 нкат/мг белка) гидролизует все эфирные связи, образованные остатками жирных кислот с С8...С20, причем наблюдается преимущественное накопление свободных пальмитиновой, олеиновой, стеариновой, миристиновой и лауриновой кислот, что соответствует их повышенному содержанию в составе молочного жира. Эти кислоты играют ведущую роль в образовании прогорклого и мыльного вкусов молока (и молочных продуктов) (Лебедев А. Б., 1985).
Результаты исследований количества образовавшихся СЖК при гидролизе молочного жира липопротеинлипазой по сравнению с жирнокислотным составом молочного жира до гидролиза показали, что характер такого гидролиза определяется не столько длиной цепи жирной кислоты, сколько ее содержанием в глицеридах (Лебедев А. Б., Уманский М. С., 1981). При этом не обнаружено зависимости между степенью гидролиза и наличием двойных связей в молекуле жирных кислот (табл. 6). Кроме того, доказано, что увеличение количества СЖК происходит в основном вследствие гидролиза триглицеридов и 1,3-диглицеридов. Содержание моноглицеридов практически не изменяется. Оптимум рН для нативной липопротеинлипазы находится между 8,0 и 9,0 (при оптимальной температуре 35...40 °С), а для микробной из Ps. aeruginosa при 5,0 и 9,0.
Таблица 6
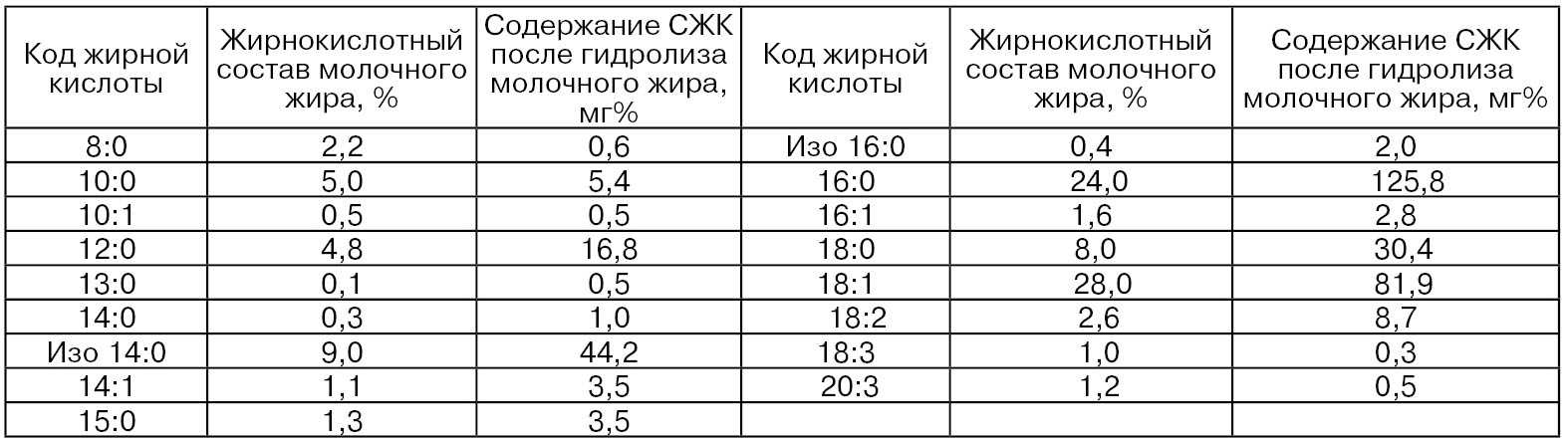
Важным свойством липопротеинлипазы, отличающим ее от липазы, является то, что она катализирует гидролиз глицеридов молока только при ее активировании липопротеинами крови – хиломикроны, ЛПОНП, ЛПНП, ЛПВП (сывороточные кофакторы) (Bachman К. С, Wilcax C. J., 1990). Установлено, что количество одного из таких активаторов – ЛПВП, содержащего не более 10 % триглицеридов, в молоке отдельных коров составляет от 9,5 до 28,1 ед./мл (1 ед. = 500 мкг/мл). В условиях центрифугирования молока при 200 g в течение 20 мин при 20 °С большая часть активатора переходит в обезжиренное молоко (от 62,0 до 100%) (Anderson М., 1983). Следовательно, в сливках по сравнению с цельным молоком активность липопротеинлипазы выражена меньше.
Рассматривают два возможных механизма действия липопротеинов крови: 1) активатор с присоединенным к нему ферментом проникает через поврежденную в той или иной степени ОШЖ; 2) активатор с присоединенным к нему ферментом присоединяется к свободному жиру (Downey W. К., 1979; Clegg R. А., 1980).
Определение содержания масляной кислоты в липолизированном липопротеинлипазой молоке показывает, что с увеличением концентрации плазмы крови количество масляной кислоты в молоке заметно возрастает. При концентрации плазмы 0; 0,002; 0,004% (по объему) концентрация масляной кислоты составляет соответственно 1,93; 3,27; 6,29 мг%. Таким образом, при наличии сывороточных кофакторов липопротеинлипаза может гидролизовать молочный жир с образованием больших количеств масляной кислоты, которая является основным соединением, обусловливающим возникновение горького вкуса молока.
Существует тесная зависимость между количеством сывороточных кофакторов в молоке и «чувствительностью» молока к липолизу (Hannan Y., Le Goff D. et al., 1990), что подтверждается данными, приведенными в табл. 7 (Jellema А.).
Таблица 7
|
Молоко |
Содержание СЖК (мл 1 н. NаОН/л) |
|||
|
0% |
0,5% |
2% |
5% |
|
|
От отдельных |
0,97 |
– |
– |
5,30 |
|
0,63 |
– |
– |
4,29 |
|
|
Сборное |
0,43 |
0,49 |
1,93 |
3,30 |
|
0,67 |
0,70 |
1,62 |
2,31 |
|
В реакции гидролиза глицеридов липопротеинлипазой принимают участие ионогенные SН- и α-аминогруппы. Так SН-группа участвует в процессе связывания ферментом глицеридов (SН-группа входит в состав сорбционного участка фермента).
Липопротеинлипаза имеет широкую молекулярную и субстратную специфичности, что предполагает существование в молекуле фермента нескольких активных центров с различной степенью сродства к тем или иным субстратам. Существует мнение и об одном активном центре фермента. В этом случае широкая субстратная специфичность фермента объясняется, по-видимому, значительной лабильностью структуры активного центра.
Ионы кальция являются активаторами липопротеинлипазы, также как и липазы. В целом процесс липолиза, связанный с активностью липопротеинлипазы, в коровьем молоке описывается следующим уравнением (А. Б. Лебедев, 1985):
Y = 0,150 + 0,069х1 + 0,01 х2 + 0,19х3 + 0,037х4,
где Y – степень липолиза, мл 0,02 М КОН/мл молока; х1 – концентрация сыворотки крови в молоке (0...5 % об.); х2 – концентрация СаСІ2 в молоке (0...0,06 %); х3 – температура молока (10...20 °С); х4 – продолжительность хранения (8...24 ч).
Из приведенного уравнения видно, что наиболее значимыми факторами липолиза молока липопротеинлипазой являются продолжительность хранения молока и концентрация в нем липопротеинов крови, вызывающие изменение конформации молекулы фермента, что приводит его в более активное состояние.
При выдержке молока в течение 8 ч при 10 °С с добавлением 5 % об. сыворотки крови 5-ти кратно увеличивается активность липопротеинлипазы, что приводит к повышению степени липолиза молока примерно в 18 раз.
На активность липопротеинлипазы в молоке стимулирующее и стабилизирующее влияние оказывает гепарин. Характер этого влияния зависит от его концентрации. Например, добавление к 1 мл молока от 0,1 до 10 мкг гепарина заметно повышало активность фермента в результате его стабилизации.
Результаты исследований молока от 135 коров показали, что при добавлении к молоку 1 ед. гепарина/мл или 10% сыворотки крови и дальнейшем хранении такого молока при 4 °С в течение 22 ч, нагревании при 60 °С с выдержкой 30 мин и замораживании при –20 °С до анализа, содержание СЖК повысилось по сравнению с контролем – (0,38 ± 0,2) соответственно до (1,54 ± 0,8) и (7,21 ± 2,2) мэкв./100 г жира, т. е. почти в 4 и 20 раз (Cartier Ph., Chilliard Y., 1989). Гепарин, видимо, освобождает липопротеинлипазу из мицелл казеина, увеличивая ее количество в водной фазе, а следовательно, и доступность к субстрату. Добавление гепарина к молоку в количествах более 10 мкг/мл приводило к существенному отделению липопротеинлипазы из мицелл казеина, а в супернатанте, после ультрацентрифугирования молока, обнаружено около 80% от общей активности фермента (Anderson M., 1982; Madkor S. A., Ibrahim F. S., Zahran A. S., 1992).
Влияние добавок к молоку – сыворотки крови и гепарина, вероятно, происходит вследствие того, что оба эти активатора действуют на разных уровнях систем – соответственно на ОШЖ и мицеллы казеина (Chilliard Y., 1982).
При определении влияния составных компонентов молока на ингибирование липолиза установлено, что добавление в молоко протеозо-пептонной фракции вызывало торможение липолиза. При этом протеозо-пептоны не взаимодействуют ни с липопротеинлипазой, ни с ее активаторами, и предполагают, что механизм ингибирования включает субстрат. Действие этих ингибиторов состоит в защите субстрата от фермента, что подтверждается повышением степени липолиза при перемешивании молока.
Ниже приведены данные по степени влияния добавления протеозо-пептонной фракции и ее отдельных компонентов на ингибирование липолиза в молоке от отдельных коров и в сборном (Anderson M., 1981):
|
Образец для анализа |
СЖК, |
|
Молоко, среднее от 8 коров – контроль |
0,163 |
|
Контроль + буфер/0,02 М-Трис-НС1, pH 8,3, 15 мкл/мл. |
0,436 |
|
Контроль + буфер/0,02 М-Трис-НС1, pH 8,3, 15мкл/мл + 1,5 мг/мл |
0,110 |
|
Молоко сборное – контроль |
0,192 |
|
Контроль + компонент 3 протеозо-пептонной фракции, 2 мг/мл |
0,072 |
|
Контроль + компонент 5 протеозо-пептонной фракции, 2 мг/мл |
0,126 |
|
Контроль + компонент 8 быстрой протеозо-пептонной |
0,171 |
Дополнительное внесение гепарина в количестве 5 мкг/мл молока от 2-х коров (при выдержке в течение 18 ч при 4°С) повышало содержание СЖК от 0,159 (контроль) до 0,578 мэкв./л, в то время как при совместном внесении протеозо-пептонной фракции 2 мг/мл и гепарина – 5 мкг/мл количество СЖК снизилось по сравнению с контролем до 0,112 мэкв./л. Таким образом, гепарин не преодолевал ингибирования липолиза протеозо-пептонной фракцией.
Ингибиторами липопротеинлипазы молока является повышенная концентрация хлорида натрия (0,5...1 М), полианионы (например, пирофосфат), соли желчных кислот, специфические Ano-липопротеины С I и С III, в противоположность – С II, который является активатором. Анионы хлора, например, препятствуют связи липопротеинлипазы с Ano-липопротеином С II (по Kitchen В. J., 1985)
Липопротеинлипаза очень чувствительна к ингибированию СЖК с длинной углеродной цепью. Вещества, которые могут связать эти СЖК, например, альбумины или ионы кальция, позволяют снизить это воздействие (Chilliard Y., 1982).
Изучение липолиза молока представляет большой практический интерес, поскольку при несоблюдении условий получения, первичной обработки и хранения молока в результате накопления продуктов липолиза молоко приобретает заметные пороки вкуса и запаха, происходят нежелательные изменения химического состава и физических свойств молока (например, снижение поверхностного натяжения) (п. 2.3). Липолиз как проблема возникновения нежелательных запаха и вкуса молока возникла впервые в печати в 1913 г. (Echles С. Н., Shaw R. Н.). С тех пор в литературе было много информации по этому вопросу и в том числе по линии ММФ (организация периодических симпозиумов) (см. Список использованной литературы).
Различают три вида липолиза молока: спонтанный, индуцированный и микробный (Downey W. К, 1980; Suchren G., 1985; Anderson М., 1987).
Спонтанный липолиз связан с активностью «мембранной» липазы и возникает в молоке спонтанно (самопроизвольно), без его сильного перемешивания. Скорость и степень охлаждения молока могут оказать значительное влияние на развитие спонтанного липолиза. Установлено, что в молоке, чувствительном к спонтанному липолизу, по сравнению с молоком нормальным, липолитическая активность, свойственная ОШЖ, выше. Чувствительность молока к спонтанному липолизу обусловливается в основном зоотехническими факторами (см. п. 2.1).
Индуцированный липолиз связан с механическим нарушением структуры ОШЖ, что приводит к увеличению контакта липаз с молочным жиром. Причинами индуцированного липолиза являются нарушение правил машинного доения коров, различные виды чрезмерного перемешивания, перекачивания и гомогенизации молока, нарушение правил транспортировки и продолжительности хранения молока при относительно низких температурах.
ОШЖ представляет собой сложный комплекс структурных белков, фосфолипидов и различных липидных компонентов. Источником структурных белков ОШЖ является плазматическая мембрана секреторных клеток молочной железы, которая окружает шарики жира во время их выхода в альвеолы. К периферическим растворимым белкам ОШЖ относятся около 30 ферментов. При охлаждении, хранении и механической обработке молока из внешнего рыхлого слоя ОШЖ происходит десорбция некоторых белковых компонентов, а на ОШЖ происходит сорбция белков молока (иммуноглобулины, казеин, β-лактоглобулин), а также липазы, которая в основном связана с казеином, и, следовательно, повышается возможность возникновения индуцированного липолиза в молоке (по Горбатовой К. К., 2004). Специальными экспериментами показано, что при удалении белков из ОШЖ степень липолиза в молоке увеличивалась, и наоборот, при добавлении выделенных белков ОШЖ липолиз снижался, что видно из нижеприведенных данных:
|
Добавление выделенных белков из ОШЖ, |
0 |
20 |
40 |
60 |
|
Липолиз, мкмоль СЖК/мл |
2,5 |
1,95 |
1,38 |
0,58 |
При этом, степень связывания липазы белками молока снижалась с почти 70 до 20%. Следовательно, некоторые белки ОШЖ являются ингибиторами индуцированного липолиза молока (Sundheim G., Bengtsson-Olivecrona G., 1987).
Микробный липолиз вызывается в основном развитием психрофильной микрофлоры молока (см. п. 2.3).
Показано, что между спонтанным (хранение молока при 4°С в течение 22 ч, затем нагревании при 60 °С с выдержкой 30 мин и замораживании при –20 °С до анализа) и индуцированным липолизом (добавление гепарина и далее при вышеприведенных условиях) отмечалась высокая линейная корреляция – r = 0,83, в то время как при индуцируемом липолизе, вызванном механической обработкой, коэффициент корреляции составил 0,70. При этом индуцированный липолиз всегда сопровождался увеличением содержания липопротеинлипазы в сливках по сравнению с контролем (Cartier Ph., Chilliard Y., 1989).
Фосфолипазы в молоке могут быть как нативными, попадающими из секреторных клеток молочной железы и из плазмы крови, так и иметь микробное происхождение. Отмечают, что нативные фосфолипазы малоактивны. Значительным источником активных фосфолипаз в молоке являются микроорганизмы рода Clostridium, Bacillus, Pseudomonas, Serratia, Acinobacter, некоторые стафилококки (Deeth H. С., Low В. А., 1979; Marhsall R. Т., 1982). Так, высокой фосфолипазной активностью характеризовались штаммы Ps. globosum; среди штаммов Ps. schermanii около 54% были высоко-, 20% средне- и 27% – низкоактивны. Вместе с тем, штаммы Ps. freudenreichii характеризовались низкой фосфолипазной активностью. Среди пропионовокислых бактерий около 48% изученных штаммов показали высокую, 15% – среднюю и 37% – низкую фосфолипазную активность. Среди лактококков наиболее высокой фосфолипазной активностью характеризовались L. lactis и L. diacetilactis и низкой – L. cremoris (Уманский М. С., Козлова Г. А., Каменская Г. А., 1980). Фосфолипазы других тканей, которые попадают в молоко из крови, имеют молекулярную массу от 10 000 до 100 000 Да.
Фосфолипазы катализируют гидролиз фосфолипидов, содержащих жирные кислоты с длинной цепью углеродных атомов (табл. 8), но проявляют активность и к другим фосфолипидам. Например, фосфолипаза А2 действует и на фосфатидилэтаноламин (кефалин) и другие фосфатиды; фосфолипаза С действует на сфингомиелин, а сфингомиелинфосфодиэстераза проявляет невысокую активность и к фосфатидилхолину (лецитину).
Таблица 8
|
Кодовый |
Фермент |
Реакция |
|
3.1.1.41) |
Фосфолипаза А2 |
Фосфатидилхолин + Н2О |
|
3.1.1.51) |
Лизофосфолипаза |
2-L-Лизофосфатидилхолин + Н2О |
|
3.1.4.32) |
Фосфолипаза С |
Фосфатидилхолин + Н2О |
|
3.1.4.42) |
Фосфолипаза D |
Фосфатидилхолин + Н2О |
|
3.1.4.122) |
Сфингомиелин- фосфодиэстераза |
Сфингомиелин + Н2О |
1) Гидролазы эфиров карбоновых кислот.
2) Гидролазы фосфодиэфиров.
Фосфолипазы А2, С (содержит цинк) и D активируются ионами кальция, а сфингомиелинфосфодиэстераза – ионами магния. Лизофосфолипаза содержит углеводы и относится к ферментам серин-гистидинового типа. Сфингомиелинфосфодиэстераза находится в связи с казеином и с ОШЖ. Изоточка этого фермента составляет pH 4,6...4,8 (по Grün Е., 1985). В результате реакций, катализируемых фосфолипазами, в молоке повышается содержание различных жирных кислот, что приводит к ухудшению его органолептических показателей (рис. 16).
Фосфолипазы представляют интерес для молочной промышленности в том отношении, что, вызывая разрушение ОШЖ путем гидролиза ее фосфолипидных компонентов (фосфолипиды составляют 50% липидов ОШЖ и значительно ее стабилизируют), они обусловливают доступ липазам молока к жиру. Таким образом, в результате действия фосфолипаз, катализирующих гидролиз фосфолипидов молока, снижается его биологическая ценность. Накопление СЖК в молоке, например при действии фосфолипазы А2 и лизофосфолипазы, является причиной липолизного (прогорклого) вкуса молока.
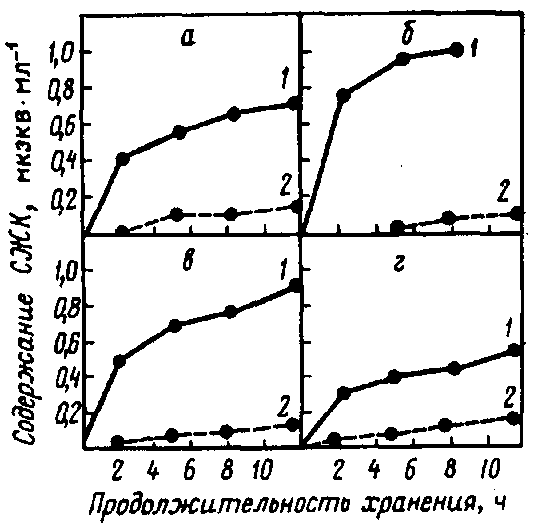
Рис. 16. Изменение содержания СЖК при хранении сырого молока (при 30 °С)
от различных коров (а, б, в, г) (Marshall R. T., 1982):
1 – с добавлением в молоко фосфолипазы C Ps. fluorescens;
2 – без добавления в молоко фосфолипазы C Ps. fluorescens
В молоке обнаружено 6 гидролаз фосфомоноэфиров, или фосфатаз. Наиболее изученными из них являются щелочная и кислая фосфатазы.
Щелочная фосфатаза (3.1.3.1) – это в основном нативный фермент молока. Источником его является, вероятно, плазмалемма секреторных клеток молочной железы. Возможно также попадание фермента в молоко и из плазмы крови. Значительно в меньшем количестве по сравнению с нативной фосфатазой в молоке содержится щелочной фосфатазы микробного происхождения (например, грибов рода Penicillium, а также бактерий Pseudomonas, Вас. cereus, Вас. mycoides, Вас. subtilis (получена в кристаллической форме, рис. 17, с. 76)). Первое сообщение о щелочной фосфатазе молока появилось в 1933 г.
Считают, что от 35 до 60 % нативной щелочной фосфатазы находится в ОШЖ молока, связано с казеином – от 20 до 60 % и с α-лактоальбумином и часть находится в свободной форме (по Grün Е., 1985). Связь щелочной фосфатазы с ОШЖ молока подтверждает тот факт, что ≈ 80 % этого фермента при сбивании сливок остается в пахте. Щелочная фосфатаза выделена из молока довольно в чистом виде с удельной активностью 43,1 Е/мг белка (Kuzuya Y., Kanamaru Y., Tanahashi T., 1982), pH изоэлектрической точки составляет 5,4...6,0.
Имеется два представления о строении молекулы щелочной фосфатазы. Одно представление состоит в том, что нативная фосфатаза является слабоосновным полиморфным, цинксодержащим гликопротеином и представляет собой олигомер, который состоит из многих субъединиц с молекулярной массой по 18 000 Да. Число субъединиц может доходить до 32, а молекулярная масса – до 576 000 Да. По второму – щелочная фосфатаза молока имеет молекулярную массу до 170 000 Да и представляет собой димер, состоящий из двух идентичных или очень подобных дисульфидно связанных субъединиц, содержащих 4 г · атома цинка на 1 моль белка (Linden G., 1979).
Получен препарат нативной щелочной фосфатазы молока с молекулярной массой (190000 ± 10000) Да. Фермент содержит 16,2% азота. В его активном центре обнаружена следующая последовательность аминокислот: аспарагиновая – серин – аланин. В целом, аминокислотный состав фермента характеризуется высоким содержанием треонина, серина, лизина и глутаминовой кислоты (Kuzuya Y., Kanamaru Y., Tanahashi T., 1982).
Из молока выделены три изоформы щелочной фосфатазы: α, β и γ. При этом наиболее активной является α-форма, которая рыхло связана с внешним слоем ОШЖ и при сепарировании молока обнаруживается в обезжиренном молоке, и β-форма – менее активная, которая прочно связана с внешним слоем ОШЖ (Linden G., Alais С., 1978). По данным Л. М. Буруяне и А. С. Георгиу (1978), в молоке фризской породы коров выявлено четыре изоформы щелочной фосфатазы.
Щелочная фосфатаза катализирует гидролиз (и синтез) большинства фосфомоноэфиров с образованием спирта и фосфорной кислоты, например:
![]()
Специфичность щелочной фосфатазы достаточно широка, и кроме фосфомоноэфиров она катализирует гидролиз серин-, треонин- и глюкозофосфата, β-глицерофосфата, АМФ, казеина. В зависимости от субстрата оптимумы pH и температуры фермента находятся соответственно в пределах 7,0...10,0 и 37 °С. При уменьшении pH активность фермента быстро снижается и при рН 5,0 практически отсутствует. Активность щелочной фосфатазы в коровьем молоке невысокая и находится в основном в пределах 0,12...0,28 Е/мл (≈ 2,0...4,7 нкат) при 37°С (по Grün Е., 1985). По Kosikowski F. V. (1988), активность щелочной фосфатазы в сыром коровьем молоке составляет 1000...1500 мкг фенола/0,5 мл. Отмечают большую изменчивость в активности этого фермента в молоке отдельных коров. Для проявления активности щелочной фосфатазе необходимо наличие ионов цинка, который является составным компонентом молекулы фермента, а в качестве активаторов – ионов магния. Слабое стимулирующее влияние на активность щелочной фосфатазы оказывают ионы кобальта, марганца и никеля (Linden G., Alais С., 1978). Ингибиторами фермента являются соли тяжелых металлов, фенилаланин, карбонаты, аскорбиновая кислота, NaCl, неорганический фосфат, лактоза, β-лактоглобулин (по Kitchen В. J., 1985).
В табл. 9 показано влияние различных фенотипов β-лактоглобулина на дефосфорилирование различных казеинов в коровьем молоке под действием щелочной фосфатазы, из которой видно, что активность фермента зависит от числа фосфатных групп в казеинах, при этом к-казеин являлся наименее восприимчивым субстратом для фермента. В целом, в большинстве случаев β-лактоглобулин ингибирует дефосфорилирование казеина щелочной фосфатазой. Не обнаружено взаимосвязи между содержанием свободного фосфора и фенотипом β-лактоглобулина с активностью щелочной нативной фосфатазы (Jasinska В., Kleczkowski К., Michalak W., 1985).
Щелочная фосфатаза играет определенную роль в синтезе некоторых компонентов молока, например, совместно с β-лактоглобулином в метаболизме фосфора в молочной железе.
Таблица 9
|
Казеин1) |
Фосфор2), |
Дефосфори-лирование, % |
Фенотип β-лактоглобулина3), % |
||
|
А |
АБ |
Б |
|||
|
β-Казеин Б |
0,76 |
30,3 |
13,7 (-55) |
8,9 (-70) |
15,5 (-49) |
|
β-Казеин А1 |
0,67 |
27,8 |
17,6 (-37) |
17,9 (-36) |
39,7 (43) |
|
β-Казеин А2 |
0,63 |
36,9 |
14,9 (-60) |
16,9 (-54) |
20,0 (-46) |
|
β-Казеин А1Б |
0,59 |
59,7 |
32,5 (-45) |
33,9 (-43) |
39,3 (-34) |
|
β-Казеин А2Б |
0,59 |
31,4 |
14,3 (-55) |
14,9 (-53) |
17,4 (-45) |
|
β-Казеин А1А2 |
0,53 |
35,8 |
20,0 (-44) |
21,5 (-40) |
19,6 (-45) |
|
Αs1-Казеин Б |
1,00 |
21,4 |
14,4 (-33) |
11,4 (-47) |
10,2 (-52) |
|
Αs1-Казеин БС |
0,91 |
20,0 |
11,4 (-43) |
6,8 (-66) |
12,1 (-40) |
|
к-Казеин А |
0,28 |
68,9 |
32,8 (-52) |
39,3 (-43) |
40,4 (-41) |
|
Цельный казеин |
0,94 |
17,2 |
15,1 (-12) |
11,1 (-36) |
24,3 (41) |
1) Концентрация 0,8 % (вес/объем);
2) мкг фосфора, освобождающегося из 100 мкг субстрата; условия реакции гидролиза казеина – рН 6,8, температура 37 °С в течение 2 ч.
3) Концентрация 0,3 % (вес/объем). Цифра в скобках показывает ингибирование (–) или активирование гидролиза казеина, %.
По данным И. А. Шумковой, коэффициент корреляции между активностью фермента и содержанием общего белка в молоке коров холмогорской породы невысокая и составляет в среднем +0,46. Вместе с тем имеется четкая прямая зависимость между содержанием в молоке коров и овец жира и активностью в нем щелочной фосфатазы, что видно из нижеприведенных данных (Linden G., Ged J.):
|
Содержание жира в сыром молоке, % |
3,48 (n = 11) |
3,89 (n = 9) |
4,29 (n = 8) |
|
Активность щелочной фосфатазы, мкмоль n-нитрофенол/мин/л |
10,0 |
38,3 |
81,5 |
Кислая фосфатаза (3.1.3.2), так же как и щелочная фосфатаза, – в основном нативный фермент молока (первое сообщение в 1945 г.). Возможным источником его происхождения являются лизосомы секреторных клеток молочной железы, плазма крови, а также и микроорганизмы (Staphylococcus, Achromobacter и Penicillium).
Считают, что от 5 до 30 % общего количества нативной кислой фосфатазы находится в ОШЖ молока. Большая часть кислой фосфатазы связана с казеином (по Grün Е., 1985). Отмечено, что фермент может иметь и лейкоцитное происхождение (п. 2.2).
Кислая фосфатаза выделена из молока с довольно высокой степенью очистки, молекулярная масса фермента составляет 40000...60000 Да. Она является слабоосновным белком и, в отличие от щелочной фосфатазы, не имеет изоформ.
Фермент представляет собой гликопротеин, содержащий галактозу, маннозу и глюкозамин. Аминокислотный состав очищенной кислой фосфатазы характеризуется высоким содержанием основных аминокислот и отсутствием метионина. В активном центре или достаточно близко к нему имеется гистидин. Отмечают, что кислая фосфатаза, выделенная из молочного жира и обезжиренного молока, несколько различаются по своим свойствам (по Kitchen В. J., 1985).
Кислая фосфатаза катализирует такую же реакцию, как и щелочная фосфатаза, но преимущественно в условиях кислой среды. Однако следует отметить более широкую специфичность этого фермента, которая распространяется на АДФ, АТФ, органические и неорганические пирофосфаты и казеин.
Кислая фосфатаза проявляет к казеину более высокую специфичность, чем щелочная фосфатаза, т. е. отщепляя от него фосфатные группы (дефосфорилирует казеин), которые играют ключевую роль в структуре казеина, образуя фосфатно-кальцевые мостики между пептидными цепями белка, что важно при производстве сыра, но, в отличие от щелочной фосфатазы, кислая фосфатаза не катализирует гидролиз серинфосфата и β-глицерофосфата (Balci А. Т., Wilbey R. А., 1999).
Учитывая субстратную специфичность кислой фосфатазы, полагают, что она должна классифицироваться как фосфопротеинфосфатаза (3.1.3.16), которая катализирует гидролиз и синтез фосфопротеинов, в том числе и казеина:
![]()
Оптимальные зоны действия фермента: pH 4,0...5,5 и температура 14...50 °С. Изоточка отмечена при pH 7,9.
По данным различных авторов, активность кислой фосфатазы в коровьем молоке невелика – в среднем от 0,011 до 0,064 Е/мл (≈ 0,18...1,07 нкат) при 37 °С, достигая 8,0...25,0% от активности щелочной фосфатазы (по Grün Е., 1985). Замечено, что молоко с высокой активностью щелочной фосфатазы имеет более низкую активность кислой фосфатазы, и наоборот. Активаторами кислой фосфатазы являются аскорбиновая кислота, ионы магния и алюминия, сульфгидрильные компоненты, а ингибиторами – соли тяжелых металлов, ионы фтора, молочная кислота, β-лактоглобулин.
Определенный интерес представляет наличие существенной положительной корреляции между активностью кислой фосфатазы и содержанием в молоке белка (коэффициент корреляции составляет от +0,6 до +0,9). Отсюда, учитывая реакцию в секреторных участках молочной железы (рН от 4 до 6), можно сделать предположение о более заметном участии кислой фосфатазы в синтезе белков молока по сравнению со щелочной фосфатазой (И. А. Шумкова). Следовательно, при более высоком содержании в молоке белка активность кислой фосфатазы в нем будет выше. Кислая фосфатаза принимает некоторое участие и в липолизе молока.
В целом следует отметить невысокие уровни секреции щелочной и кислой фосфатаз в молоко. Так показано, что активность щелочной фосфатазы в молоке составляет ≈ 5 и 7% от активности таковой в элементах секреторных клеток молочной железы – при использовании субстрата динатрийфенилфосфата при рН 8,10 и 9,64 соответственно. В то время как активность кислой фосфатазы составила ≈ 3 и 1,5% при использовании того же субстрата и при рН 4,13 и 5,30 соответственно. Это свидетельствует о значительной роли этих ферментов в биохимических процессах молочной железы (И. А. Шумкова).
Фосфатидатфосфатаза (3.1.3.4) является, видимо, только нативным ферментом молока, принимая участие в липидном обмене клеток молочной железы, где проходит синтез триглицеридов и фосфолипидов молока. Этот фермент катализирует следующую реакцию:
![]()
Субстратом для фосфатидатфосфатазы служит соединение, которое образуется и при действии фосфолипазы D на фосфатидилхолин молока (см. «Фосфолипазы»). Получающийся в результате реакции диглицерид в дальнейшем подвергается гидролизу липазами молока с образованием жирных кислот, участвующих в формировании несвойственных молоку запаха и вкуса (см. «Липазы»).
Возможным источником происхождения 5'-нуклеотидазы (3.1.3.5) в молоке является плазмалемма секреторных клеток молочной железы, а местонахождением – внешняя сторона ОШЖ молока (рис. 8, с. 27), из которых выделены две 5'-нуклеотидазы I и II, различающиеся некоторыми свойствами, например, имеют различную субстратную специфичность, кинетические характеристики и содержание фосфолипидов. В табл. 10 приведен фосфолипидный состав этих двух форм 5'-нуклеотидаз.
Таблица 10
|
Фосфолипид |
Общий липидный фосфор – |
|
|
I |
II |
|
|
Сфингомиэлин |
78,0 |
21,1 |
|
Фосфатидилхолин |
22,0 |
34,7 |
|
Фосфатидилсерин |
– |
8,8 |
|
Фосфатидилинозитол |
– |
7,5 |
|
Фосфатидилэтаноламин |
– |
27,9 |
Обе формы фермента ингибируются ионами ртути, а высокомолекулярная форма I активируется ионами магния, но ингибируется высокими концентрациями этого металла. Форма II фермента инактивируется только слабым количеством (1 ммоль) ионов магния и значительно – около 60 % их концентрацией 5 ммоль. Конкурентным ингибитором 5'-нуклеотидазы является АТФ (по Kitchen В. J., 1985).
Изоэлектрические точки двух форм 5'-нуклеотидаз находятся при рН 4,9 и 5,9, а по другим данным – ≈ 4,4 и ≈ 7,3 соответственно; удельные активности составляют 4,09 и 5,53 Е/мг белка, а Км – 0,94 и 5,0 ммоль соответственно. Фермент имеет широкую специфичность в отношении 5'-нуклеотидов, например АМФ, ГМФ и ЦМФ.
5'-Нуклеотидаза катализирует следующую реакцию:
![]()
Оптимальные рН и температура для обеих форм 5'-нуклеотидазы находятся в пределах 7,0...7,5 и 60...70 °С.
Различные рибонуклеотиды, служащие в той или иной степени субстратами для 5'-нуклеотидазы в организме животного и, в частности, молочной железе, играют важную роль в биосинтезе липидов и углеводов молока.
Основная роль 5'-нуклеотидазы в молоке состоит в ее величине, как маркера для клеточной плазмы мембранного материала, и его использование в изучении биогенеза оболочек шариков жира и механизма секреции шариков жира молока.
Кроме рассмотренных выше фосфатаз, в молоке обнаружена активность и некоторых других фосфатаз, которые принимают участие в гликолизе молока, это глюкозо-6-фосфатаза и фруктозобифосфатаза.
Глюкозо-6-фосфатазу (3.1,3.9) считают нативным ферментом молока. Возможным источником его в молоке является эндоплазматический ретикулум секреторных клеток молочной железы, а местонахождением – ОШЖ молока (по Grün Е., 1985). Глюкозо-6-фосфатаза катализирует следующую реакцию:
![]()
Кроме этого, фермент действует и на D-глюкозамин-6-фосфат.
Фруктозобифосфатаза (3.1.3.11) катализирует следующую реакцию:
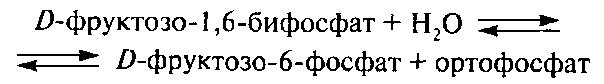
Следует отметить, что функции фосфатаз, кроме непосредственного участия в синтезе и гидролизе фосфосоединений молока, в достаточной степени связаны с использованием организмом фосфора молока, 40...50 % которого находится в органических соединениях. Фосфатазы молока, катализируя гидролиз органических соединений фосфора, способствуют их всасыванию.
В молоке обнаружена незначительная активность арилсульфатазы (3.1.6.1), однако ее местоположение и роль в молоке неизвестны. Активность этого фермента составляет 0,004...0,007 Е/мл (≈ 0,07...0,12 нкат) при 50 °С (по Grün Е., 1985). Арилсульфатаза катализирует следующую реакцию:
![]()
Имеются результаты исследований о наличии в молоке рибонуклеаз (РНКаз) и дезоксирибонуклеаз (ДНКаз), которые относятся к деполимеразам РНК. (Адигамов Л. Ф. 1986; Fox Р. F., 1995).
К гидролазам, действующим на сложноэфирные связи, относится обнаруженная в молоке рибонуклеаза (панкреатическая) (3.1.27.5), возможным источником которой являются лизосомы секреторных клеток молочной железы, содержащиеся в молоке клеточные элементы и наиболее вероятно – плазма крови. Имеются данные, что некоторые молочнокислые бактерии образуют внеклеточные РНКазы и ДНКазы.
Фермент обнаружен в ОШЖ, связанных с казеином – 26 % и 74 % его обнаруживается в молочной сыворотке (по Grün Е., 1985).
Впервые Bingham Е. W., Zitte С. А. (1962 г.) выделили из сырого коровьего обезжиренного молока рибонуклеазу в чистой форме. Она была получена в качестве сопутствующего продукта при выделении лактопероксидазы и некоторых минорных белков. При этом были получены две формы фермента: А и Б (из 1 л молока выделено соответственно 1,56 и 0,40 мг). По аминокислотному составу, специфичности и целому ряду характеристик молочная рибонуклеаза А гомологична панкреатической рибонуклеазе А, молекула которой представляет собой полипептид из 124 аминокислот. Аминокислотный состав фермента приведен в табл. 1, с. 29. Рибонуклеаза А – это низкомолекулярный белок (молекулярная масса 13 700 Да). Она является основной формой фермента, составляя 70...90 % общей рибонуклеазной активности молока. Рибонуклеаза Б по аминокислотному составу идентична рибонуклеазе А, но является гликопротеином, содержащим 4,2 % гексозамина (3,0 % глюкозамина и 1,2 % галактозамина) и ≈ 5,2 % маннозы. Молочная рибонуклеаза Б отличается от панкреатической рибонуклеазы Б, содержащей около 2,2 % глюкозамина и 5,7 % маннозы. В состав активного центра молочной рибонуклеазы входят лизин и гистидин. Содержание этого фермента в молоке составляет в среднем 25 (12...32) мг/л.
Сведения о влиянии ионов кальция на активность рибонуклеаз молока различных видов сельскохозяйственных животных и данные о механизме действия этих ферментов позволяют разделить их на 2 основные группы – стимулируемые и нестимулируемые ионами кальция. Показано, что источником кальций-зависимой рибонуклеазы является молочная железа. Этот фермент обнаружен только в лактирующей железе и синтезируется в ней, в то время как кальций-независимая рибонуклеаза происходит из других вышеуказанных источников. Рибонуклеаза коровьего молока, активность которой не стимулируется ионами кальция, гидролизует в основном эндонуклеотическое расщепление полиуридиловой и цитидиловой кислот и неактивна к полиадениловой кислоте, но проявляет некоторую активность к полигуаниловой кислоте. В целом рибонуклеаза является высокоспецифическим ферментом и катализирует эндонуклеотическое расщепление полирибонуклеотидов (РНК) с образованием 31-фосфомоно- и олигонуклеотидов. Фермент гидролизует также 21, 31-циклические нуклеотиды цитидина и уридина.
Следует отметить чрезвычайное сходство физико-химических свойств и специфичности рибонуклеаз коровьего молока, слюнных желез и женского молока.
Рибонуклеаза из коровьего молока получена в кристаллической форме. Ее кристаллы по форме прямоугольные (слегка неровные) и тонкие (рис. 17). Удельная активность кристаллической рибонуклеазы составляет 2,21 ед./мг белка (1 ед. соответствует количеству фермента, вызывающего повышение поглощения на 1,0 при 260 нм) (Groves М. L.).
Кристаллическая рибонуклеаза устойчива к высоким температурам и низким значениям рН. Так, она стабильна при нагревании до 90 °С в диапазоне рН 2,0...4,5, но инактивируется при высоких значениях рН.
Оптимальными условиями действия фермента являются рН 7,5 и температура 37 °С. Изоэлектрическая точка находится при рН 7,8. Ингибиторами фермента являются медь, цинк, ртуть и другие соединения.
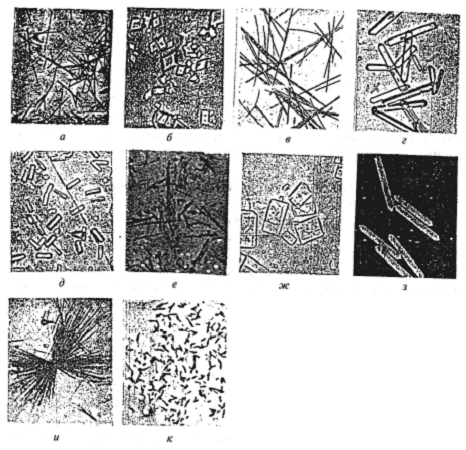
Рис. 17. Кристаллические формы некоторых гидролаз и лиаз
(по Диксон М., Уэбб Э., 1982; е – по Groves М. L.):
а – α-амилаза, Bacillus subtilis, х110; б – α-амилаза, Aspergillus, х210; в – α-амилаза, Bacillus stearothermophilus, х210;
г – щелочная фосфатаза, Bacillus subtilis, х220; д – дезоксирибонуклеаза I, поджелудочная железа быка, х250;
е – рибонуклеаза, коровье молоко, х250; ж – рибонуклеаза I, поджелудочная железа быка, х190;
з – β-D-галактозидаза, Е. coli, х200; и – кислая протеиназа, Aspergillius oryzae, х300; к – триптофаназа, Е. coli, х2000
Имеются данные о третьей форме рибонуклеазы в коровьем молоке – рибонуклеаза II, которая подобна панкреатической рибонуклеазе А и Б. Ее содержание в сыром коровьем молоке составляет около 50 мкг белка рибонуклеазы А/мл. Активность рибонуклеазы II, преимущественно, характерна для водной фазы молока – около 94%, в сливках ее активность составляет 4% и в нерастворимом осадке – 2 %. При осаждении казеина (рН 4,3) активность этого фермента составляла 88 % – в сыворотке и 15 % – в казеине от общей активности. Рибонуклеаза II молока обычно имеет свои изоформы, например рибонуклеаза II-1, для которой характерна уникальная способность не гидролизовать полицитидиловую кислоту (Meyer D. Н., Kunin A. S, et al., 1987). Ниже приведены данные по распределению активности трех форм рибонуклеазы в сыром коровьем молоке.
|
Рибонуклеазы |
А |
Б |
II-1 |
|
Активность, ед./мл[2] (% общей активности) |
5300/72/ |
2000/27/ |
63/1/ |
Роль и значение рибонуклеазы в молоке в настоящее время изучены недостаточно. Вместе с тем следует отметить, что микросомы молока содержат около 0,25 % РНК, которая служит связующим компонентом для других компонентов, составляющих микросому (см. рис, 15, с. 56). Поэтому гидролиз РНК в микросомах ОШЖ, во-первых, может быть причиной снижения стабильности жировой фазы молока и, во-вторых, повышения активности ряда ферментов в молоке, которые содержатся в микросомах (как ОШЖ, так и в свободном состоянии).
Исследования показали, что в пахте содержание рибонуклеазы выше, чем в исходном молоке как при использовании метода сбивания, так и преобразования высокожирных сливок – соответственно 120 и 75 мг/л. Это повышение связано с разрушением структуры шариков жира. При этом количество лизоцима в пахте по сравнению с исходным молоком снижается на 20...30% независимо от технологических режимов производства масла, поскольку лизоцим, как глобулиновый белок при сепарировании молока в основном переходит в обезжиренное молоко (Шалыгина А. М., Тихомирова Н. А., Федорова Т В., Ионова И. И., Комолова Г. С, 1999).
Следует отметить, что рибонуклеаза, попадающая в организм с молоком, как белок с небольшой молекулярной массой, хорошо проникает и задерживается. Этот фермент молока следует рассматривать как один из факторов, участвующих в иммунитете организма в постнатальный период. В условиях, когда собственные защитные механизмы организма еще не сформировались в полном объеме, роль поступающих с молоком факторов неспецифического иммунитета может оказаться особенно значимой. Полагают, что рибонуклеаза действует совместно с лизоцимом, который повреждает структурные элементы клеточной стенки патогенных микроорганизмов, а рибонуклеаза далее разрушает клеточные РНК (Адигамов Л. Ф., 1986; Тихомирова Н. А., Комолова Г. С., Ионова И. И., 2004).
Установлена незначительная активность фосфодиэстеразы (3.1.4.1) (5'-экзонуклеаза) связанной с казеином и ОШЖ молока. Этот фермент гидролитически отщепляет 5'-нуклеотиды последовательно с 3'-гидроксильного конца олигонуклеотидов.
Дезоксирибонуклеазы молока являются ферментами нативного (попадают из крови) и бактериального происхождений. При этом ферменты нативного происхождения более лабильны к тепловой обработке, их максимальная активность лежит в области pH 5,0...5,5. Дезоксирибонуклеазы обнаружены в различных тканях животного организма.
Среди дезоксирибонуклеаз молока различают дезоксирибонуклеазу I (3.1.21.1) (панкреатическая) и дезоксирибонуклеазу II (3.1.22.1) (селезеночная), которые катализируют эндонуклеотическое расщепление полидезоксирибонуклеотидов (ДНК) с образованием 5'-фосфоди- и олигонуклеотидов и 3'-фосфомоно- и олигонуклеотидов соответственно.
Активность дезоксирибонуклеаз в коровьем (и овечьем) молоке составляет менее 1 диффузных ед/мл. При этом активность этих ферментов более чем в 170 раз в молозиве коров и в 35 раз в молозиве овец превышает эту активность в нормальном молоке. Следовательно, они играют большую роль в развитии организма в первые дни (Gudding R. 1979).
В США в 1985 г. (Fett J. W, Strydom D. J. et al.) открыт новый представитель семейства панкреатических рибонуклеаз, оказавшийся активным индуктором роста кровеносных сосудов. И в связи с этим названный ангиогенином (от греч. angion – сосуд), а в 1988 г. ангиогенин обнаружен в коровьем молоке (Maes Р., Damart D. et al.). Структура, физико-химические и ферментативные свойства ангиогенина достаточно полно изучены (Комолова Г. С, Федорова Т. В., 2002).
Существует по крайней мере 3 молекулярные формы ангиогенина молока. Наиболее представительным является полипептид из 125 аминокислотных остатков с молекулярной массой около 14 600 Да (по структурно-функциональной организации он идентичен ангиогенину, выделенному из крови быка). В связи с этим, независимо от того, из крови или молока выделена эта молекулярная форма белка, ее обозначают одинаково – бычий ангиогенин-1. Гомологичность его ангиогенину человека составляет 65…71%, а панкреатической рибонуклеазе А – 34 %.
Ангиогенин-1 – основной белок с изоэлектрической точкой более 9,5 рН. Наиболее значимыми для ферментативной активности ангиогенина-1 являются аминокислоты – гистидин и лизин.
Другим ангиогенным белком молока является бычий ангиогенин-2 (Strydom D. J., Bond М. D., Vallee В. L, 1997). Это одноцепочечный полипептид из 123 аминокислотных остатков, имеет более высокую молекулярную массу – около 20 000 Да, что обусловлено его гликозилированием. Амино- и карбоксилконцевые остатки представлены пироглютаминовой кислотой и пролином соответственно. Гомологичность ангиогенина-2 ангиогенину-1 составляет 57 %.
Третьей молекулярной формой ангиогенина в коровьем молоке является лактогенин (Ye X. Y., Cheng К. J., Ng T. В., 1999). Его молекулярная масса составляет около 17000 Да. Этот белок не гомологичен ангиогенину-2, хотя и сходен с ним в некоторых позициях аминокислотной последовательности.
У всех известных ангиогенинов наличие трех дисульфидных мостиков в молекуле белка определяет довольно жесткую пространственную ее структуру, вследствие чего молекула устойчива к механическим воздействиям и низким значениям рН.
Молекулярные формы ангиогенина молока несколько различаются между собой как по активности, так и по субстратной специфичности. Их ферментативные свойства определяются не столько первичной структурой критических для нее довольно консервативных участков, сколько расположением их в молекуле, т. е. пространственной структурой. Ангиогенин из коровьего молока обладает ограниченной рибонуклеазной активностью, расщепляет РНК на довольно длинные фрагменты (100...500 оснований) и не катализирует гидролиз некоторых полирибонуклеидов, например полицитидиловую и пулиуридиловую кислоты. Показано, что активность ангиогенина-1 выше, чем ангиогенина-2, а активность лактогенина выше активности ангиогенина-1.
Плацентарный ингибитор рибонуклеазы молока является также ингибитором ангиогенина, причем скорость и степень связывания его с ангиогенином значительно превышает таковые с рибонуклеазой А. При ингибировании образуется довольно стабильный комплекс, в составе которого в молекуле ангиогенина нарушается пространственная ориентация, что является критическим для его ферментативной активности.
Литературные данные, касающиеся биохимических свойств ангиогенина из различных источников, свидетельствует об его полифункциональности (Тихомирова Н. А., 1999).
Показано, что выделенные из коровьего молока ангиогенина-1 и лактогенин ингибируют синтез белка в лизатах ретикулоцитов кролика на 50 % при концентрациях ниже 100 нмоль. Выделенный из коровьего молока ангиогенин в концентрации ≈ 0,15 мкг/мл контролирует образование меланина в клетках. Недавно обнаружен бактериостатитический эффект ангиогенина. Он тормозит рост кишечной палочки. Возможно, что устойчивый к протеолитическим ферментам и низким значениям рН этот фермент является одним из неспецифических антимикробных факторов молока и может проявлять свое действие уже в желудочно-кишечном тракте.
Есть основание полагать, что ангиогенин молока участвует в передаче пассивного иммунитета при скармливании молодняка, на что указывает его синтез в молочной железе и зависимость содержания в молоке от физиологических факторов, связанных с репродуктивной функцией лактирующих животных. Очевидно, не случайно в ранний период лактации в молоке, и особенно в молозиве, отмечается высокий уровень ангиогенина.
Биологическая активность ангиогенина коровьего молока (в модификации кожной пробы по Г. С. Комоловой) исследована И. И. Ионовой (1998 г.), показавшая активный рост кровеносных сосудов в коже ушной раковины и на роговице глаза крысы. Ангиогенин рассматривают также как активный фактор костеобразования.
Содержание ангиогенина в коровьем молоке зависит от сезона года (летом оно выше), генетических, физиологических, зооветеринарных и технологических факторов. Анализ литературных данных показывает, что этот показатель колеблется от 1 до 8 мг/л. В свежевыдоенном молоке коров, например, черно-пестрой породы (Московская область), содержание ангиогенина составляет 2...5 мг/л, а в молоке, поступившем на молочные предприятия, обычно не превышает 1,5 мг/л.
Ю. Л. Рустамьян (2005 г.) из свежевыдоенного коровьего молока (используя его обезжиренную фракцию) при применении катионообменной и гидрофобной хроматографии разработал способ получения электорофорически чистого нативного препарата ангиогенина-1 (выход 49 %, степень очистки 12 000 раз) в количестве около 1,5 мг/л. Для количественного определения ангиогенина-1 адаптирован конкурентный метод иммуноферментного анализа. Показано, что ангиогенин-1 молока как биологически активный фактор при перроральном введении его мышам проникает в кровь из ЖКТ в зависимости от возраста животного в различных концентрациях. На основании фармакокинетических исследований установлена высокая скорость обмена инъекцированного животным ангиогенина-1 молока в головном мозге и тимусе.
С учетом известных физиологических функций ангиогенина, и в частности из молока, можно прогнозировать перспективу его применения в медицине и косметологии. На его основе могут быть созданы лекарственные формы для лечения с недостатком тканевого кровоснабжения. В Японии начата разработка препаратов с ангиогенином молока, предназначенных для детей и молодых людей с проблемами роста. Просматривается возможность получения из ангиогенина молока пищевых добавок к детским и диетическим продуктам специального назначения (Комолова Г. С, Федорова Т. В., 2002).
Ниже приведены данные по содержанию ангиогенина во вторичном молочном сырье, получаемого при производстве основных видов молочных продуктов (Федорова Т. В., 2003):
|
Вторичное сырье |
Содержание ангиогенина, |
|
Сыворотка: |
|
|
творожная |
0,5...0,8 |
|
подсырная |
0,9...1,2 |
|
Пахта при производстве масла: |
|
|
способом сбивания сливок |
0,6…0,9 |
|
способом преобразования сливок |
0,09...0,13 |
|
Ультрафильтрат: |
|
|
цельного и обезжиренного молока |
0,5...0,8 |
|
подсырной сыворотки |
0,18...0,27 |
Следует отметить, что содержание ангиогенина в коровьем молоке в основном превышает его содержание в сыворотке в 1,5...3,0 раза, в то время как содержание рибонуклеазы соответственно в среднем в 5...6 раз, что свидетельствует о большей стойкости ангиогенина к технологическим факторам по сравнению с рибонуклеазой. Устойчивость ангиогенина к технологическим факторам открывает перспективы использования сыворотки в качестве его дешевого источника (Шалыгина А. М. и др., 1997).
Для выделения ангиогенина из молочного сырья обычно используют ионообменную хроматографию с применением наиболее эффективного сорбента – СМ-целлюлозы (марки СМ-32 и сухой аналог марки СМ-52). Получение ангиогенина из вторичного молочного сырья имеет преимущества по сравнению с молоком, т. к. при этом исключаются этапы обезжиривания и удаления казеиновой фракции.
Кроме чистых препаратов ангиогенина представляют интерес белковые концентраты, обогащенные ангиогенином, получение которых из вторичного молочного сырья может войти в схемы безотходной его переработки на основе мембранной технологии (Федорова Т. В., 2003).
Гликозидазы. Из гликозидаз, катализирующих гидролиз о-гликозильных соединений в молоке, обнаружены активности 12 ферментов нативного и микробного происхождений.
Следует отметить, что наиболее активными продуцентами многих гликозидаз являются психрофильные бактерии. Так, например, из 19 исследованных психрофильных бактерий молока 6 продуцировали большое количество гликозидаз, в том числе Enterobacter-4, Citrobacter-1, Pseudomonas-1.
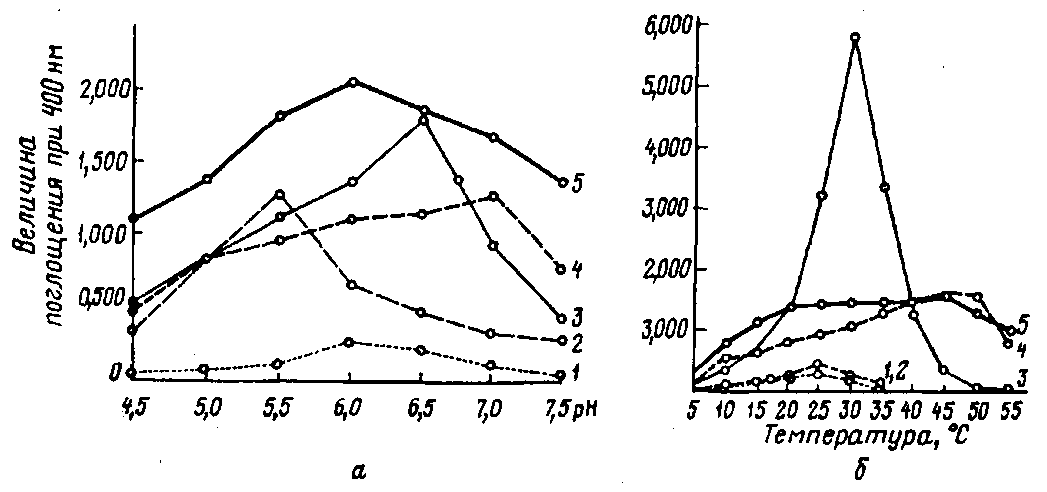
Рис. 18. Активность гликозидаз Ps. fluorescens в зависимости от рН (а) и температуры (б) (Marshall R.T., 1982):
1 - α-маннозидаза; 2 – β-глюкозидаза; 3 – β-галактозидаза; 4 – N-ацетил-β-глюкозаминидаза; 5 – N-ацетил-β-галактозаминидаза
На рис. 18 показаны пределы pH и температуры проявления активности некоторых гликозидаз Ps. fluorescens.
Наиболее изученными из гликозидаз являются амилазы, лизоцим, β-галактозидаза и N-ацетил-β-глюкозаминидаза.
α-Амилаза (3.2.1.1) и β-амилаза (3.2.1.2) (диастазы, гликогеназы) – однокомпонентные, в основном, нативные ферменты, но встречаются и микробного происхождения. Обе амилазы выделены из обезжиренного коровьего молока и очищены. Коферментом их молекул являются ионы кальция. На 1 моль фермента имеется, по крайней мере, 1 г · атом прочносвязанного кальция, который стабилизирует вторичную и третичную структуры фермента, обеспечивая его каталитическую активность, и предохраняет фермент от действия ингибиторов. Наличие α-амилазы в коровьем молоке впервые обнаружено в 1904 г. и использовано в качестве индекса пастеризации молока, а β-амилазы – в 1936 г. (Shahani С.М.).
Установлено, что нативные амилазы связаны в основном с лактоглобулином молока, по некоторым данным, они частично связаны с казеиновой и жировой фракциями молока.
В табл. 11 показано распределение активности α-амилазы в цельном и обезжиренном молоке, сыворотке и сывороточных белках.
Таблица 11
|
Молоко |
Относительная степень разжижения 3%-ного |
||||
|
Цельное молоко |
Обезжиренное молоко |
Сыворотка кислая |
β-лакто глобулин1) |
α-лакталь- |
|
|
Сборное сырое |
19,0 |
19,7 |
– |
– |
– |
|
Коммерческое |
13,5 |
14,1 |
9,1 |
6,1 |
Незначи- |
|
» |
17,4 |
19,8 |
16,2 |
6,2 |
» |
|
» |
15,6 |
16,7 |
9,5 |
10,4 |
Несущест- |
|
» |
– |
15,0 |
8,9 |
9,4 |
1,0 |
1) Осадок, полученный при 43%-ном насыщении сернокислым аммонием при рН 6,2.
2) Фильтрат, остающийся после осаждения β-лактоглобулина.
Некоторые α-амилазы микробного происхождения получены в высокоочищенном состоянии и в кристаллической форме (рис. 17, с. 76). Молекулярная масса α-амилазы из Asp. Oryzae составляет около 52 000 Да, из некоторых микромицетов – от 45 000 до 50 000, а из Вас. subtilis – 96 000 Да (Жеребцов Н. А., Корнеева О. С, Фарадаева Е. Д., 1999).
В молоке α-амилазы различного происхождения существенно различаются по содержанию ряда аминокислот, что обусловливает отличия их между собой по некоторым свойствам, например термостойкости (В. Л. Кретович). α-Амилаза является постоянно присутствующим в молоке ферментом, в то время как β-амилаза обнаруживается значительно реже.
Амилазы катализируют гидролиз крахмала, гликогена и родственных олиго- и полисахаридов, расщепляя 1,4-α-D-гликозидные связи. При этом α-амилаза катализирует этот гидролиз внутри молекулы субстрата с образованием продуктов неполного гидролиза – декстринов, а при полном гидролизе – мальтозы и глюкозы, а β-амилаза последовательно катализирует гидролиз с нередуцирующих концов цепей субстрата с образованием мальтозы. При совместном действии α- и β-амилаз на субстрат, например крахмал, образуется около 95 % мальтозы и 5 % – низкомолекулярных предельных декстринов, содержащих 1,6-α-гликозидные связи, которые не расщепляют α- и β-амилазы.
Активность α-амилазы в молоке составляет в среднем от 0,3 до 1,8 Е/мл (≈ 5...30 нкат) при 37°С (по Grün Е., 1985). Оптимумы действия α-амилазы – от рН 5,7 до 7,4 при 34...37 °С. Для действия β-амилазы необходима более кислая среда рН 4,2. Ингибитором α-амилазы является йод, а активаторами – ионы кальция и хлора.
В молоке реально наличие глюкан 1,4-α-глюкозидазы (3.2.1.3) (глюкоамилазы), которую продуцируют, например, Aspergillus, Endomyces и Rhizopus. Действуя последовательно с нередуцирующих концов цепей полисахаридов, фермент отщепляет молекулы β-глюкозы. При этом фермент расщепляет не только 1,4-α-D-, но и 1,6-α-D-гликозидные связи. Оптимумы действия фермента составляют – pH 4...5 при 50...60°С.
Лизоцим (3.2.1.17) (мурамидаза) широко распространен в природе, у животных он обнаружен в сыворотке крови, слезной жидкости, в слюне, слизистой оболочке носа и др. Лизоцим в молоке впервые обнаружен в 1922 г. (Fleming М. G.).
Лизоцим, вырабатываемый молочной железой или попадающий в молоко из крови, представляет собой фактор естественного иммунитета и отличается от других его факторов широтой спектра антибактериального действия. Поэтому из всех антибактериальных веществ молока наибольший интерес с санитарно-гигиенической и технологической точек зрения представляет именно лизоцим. Лизоцим является одним из основных ферментов, предупреждающих возникновение инфекционных процессов в молочной железе и порчи молока. Он частично обусловливает бактерицидную фазу молока, а наряду с лактопероксидазой составляет нативную антибактериальную ферментную систему молока.
Лизоцим выделен из молока, очищен с использованием ионно-обменной и гель-проникающей хроматографии (по Kitchen В. J, 1985) и представляет собой высокоосновный белок с молекулярной массой 18 000 Да. Предполагают, что это глобулин (изоэлектрическая точка при рН 9,5), имеющий общее происхождение с α-лактальбумином. Четкой связи лизоцима с какой-либо фракцией молока не установлено.
Молекула лизоцима состоит из 154 аминокислот, аминокислотный состав лизоцима приведен в табл. 1, с. 29. При этом тирозин, триптофан и лизин ответственны за проявление активности фермента (Eitenmiller R. R., Friend В. A., Shahani К. М.).
Действие лизоцима заключается в гидролизе мукополисахаридов и мукопептидов пептидогликанового слоя клеточной оболочки бактерий путем расщепления 1,4-β-связи между N-ацетилмурамовой кислотой и N-ацетил-D-глюкозамином, что приводит к лизису клеток.
Активатором лизоцима является натрия хлорид. Оптимальные условия действия лизоцима: pH 7,4...7,9 и температура 37 °С. Активность лизоцима в 1 мл молока составляет 100...300 ед. (1 ед. соответствует количеству фермента, вызывающего снижение величины оптической плотности смеси молока и суспензии М. lysodeikticus на 0,001 за 1 мин при 37°С).
Содержание лизоцима в коровьем молоке составляет в среднем 13 мкг%, а активность – 0,15...1,5 Е/мл (≈ 2,5...25 нкат) (по Grün Е., 1985). Содержание и активность лизоцима в молоке характеризует состояние естественной резистентности коров.
По В. И. Мутовину, в молоке (нормальном, стародойном) и молозиве (анализ около 15 000 проб) имеется не менее 6 типов лизоцимов: лизоцим молока (М), лизоцим молочной железы (МЖ), лизоцим термостойкий (Т), лизоцим молозивный (Мз), лизоцим основной (О), лизоцим инверсионный (И). Лизоцим типа О характерен для молозива, а типа И – для молока коров, больных маститом. Эти типы лизоцима различаются спектром антибактериального действия, диффузией в агар и др. Более важными являются лизоцимы типов М и Т, поскольку они вызывают лизис наиболее неблагоприятных в санитарном отношении например, Stph. aureus, обладающих гемолитической активностью (Королева Н. С, Семенихина В. Ф., 1980).
По Степаненко П. П. (1999 г.) в молоке находятся 4 типа лизоцимов: М, МЖ, О и Т. При этом лизоцим М обладает наибольшей бактерицидной активностью, губительно действуя на патогенные стафилококки, маститный стрептококк, сальмонеллы, кишечные палочки, возбудителя сибирской язвы и др. Отсутствие в свежевыдоенном молоке лизоцима М свидетельствует о заболевании молочной железы.
Восприимчивость различных микроорганизмов к лизоциму зависит от доступности субстрата. Грамположительные бактерии более восприимчивы, т. к. их клеточная оболочка состоит в основном (90 %) из пептидгликана, в то время как стафилококки более устойчивы к лизоциму по причине наличия в их клеточной оболочке тейхоевой кислоты, которая препятствует доступу лизоцима к его субстрату. У грамотрицательных бактерий содержание пептидгликана в клеточной оболочке составляет 5... 10 %, который защищен снаружи липополисахаридом, препятствующим лизоциму достичь субстрата. Но этот барьер может быть разрушен различными химическими и физическими обработками и тогда эти микроорганизмы становятся чувствительными к лизоциму (Бюллетень ММФ, 1991, № 264).
В целом, содержание лизоцима в крови и в других секретах, в частности в молоке, используют как тест, характеризующий состояние естественной резистенции организма, а по количеству его в молоке можно судить о биологической полноценности молока.
Инверсия лизоцимов типов М и Т является показателем изменений физико-химических свойств молока, что следует учитывать при оценке его технологических свойств. Так, при изменении величины соотношения титров лизоцимов типов М : Т от 110 до 78 продолжительность сычужного свертывания молока увеличивается в 5...8 раз.
Ниже приведены результаты исследований около 400 проб молока в различных хозяйствах Семипалатинской области по определению активности лизоцима по зоне задержки роста золотистого стафилококка (Шагиахметова Р. К., 1984).
Количество проб молока с зоной задержки роста золотистого стафилококка (в %):
|
Следы |
16,1 |
|
До 20 |
13,2 |
|
До 30 |
48,5 |
|
До 40 |
10,5 |
|
Более 40 мм |
11,7 |
Технологическое значение лизоцимов молока состоит еще и в том, что они заметно усиливают антагонистическую активность молочнокислых бактерий. Поэтому при производстве молочных продуктов, где применяются закваски молочнокислых бактерий, целесообразно использовать штаммы, высокоустойчивые к лизоцимам молока.
В молоке возможно наличие β-глюкозидазы (3.2.1.21) (целлобиаза), активным продуцентом которой являются психрофильные бактерии, в том числе Ps. fluorescens (рис. 18). Кроме того, этот фермент частично связан с ОШЖ (активность 0,05 Е/мл – ≈ 0,8 нкат) и, следовательно, имеет и нативное происхождение (по Grün Е., 1985). Фермент гидролизует 1,4-связи концевого нередуцирующего остатка β-D-глюкозы с освобождением β-D-глюкозы.
β-Галоктозидаза (3.2.1.23) (лактаза) молока имеет различное происхождение. Источником нативного фермента служат лизосомы секреторных клеток молочной железы и лейкоциты. Но основным источником β-галактозидазы являются микроорганизмы. В больших количествах этот фермент продуцируют молочнокислые бактерии, бактерии группы кишечной палочки, психротрофильные бактерии, дрожжи и другие микроорганизмы, попадающие в молоко (Chang В. S., Mahoney R. R., 1989).
Показано, что β-галактозидазная активность дрожжей и бактерий (лактококки и молочнокислые палочки) составляет соответственно 78,1...92,3 и 0,44...705 ед. (1 ед. соответствует количеству фермента, необходимого для образования 1 мкмоль о-нитрофенола/мин при 45 °С). Высокую активность показывают отдельные штаммы Str. thermophilus (Ганина В. И., Калинина Л. В., Большакова Е. В., 2002).
Активным продуцентом β-галактозидазы является также Ps. fluorescens (рис. 18). Лактаза, продуцируемая Ps. fluorescens, проявляет наибольшую активность при pH 6,5...6,7, свойственном цельному молоку, при температуре ≈ 30 °С. Из некоторых микроорганизмов β-галактозидаза выделена и получена в кристаллической форме (В. Л. Кретович) (см. рис. 17). Молекулярная масса этого фермента, в зависимости от вида микроорганизма, находится в диапазоне 20 000...50 000 Да. Вместе с тем, молекулярная масса β-галактозидазы из Penicillinum sp. составляет 120 000 Да, установлена ее аминокислотная последовательность и показано, что она является гликопротеином, содержащим 7 N-связанных олигосахаридных цепей (Rojas A. L., Nagem R. A. et al., 2004).
Нативная β-галактозидаза в молоке обнаружена в ОШЖ, активность которой составляет 0,71 Е (Anderson М., Chisman G. К., 1982).
β-Галактозидаза катализирует гидролиз лактозы молока путем отщепления концевых нередуцирующих остатков β-D-галактозы в β-raлактозидах с образованием β-D-галактозы и D-глюкозы.
Следует отметить, что лактоза не только хорошо гидролизуется β-галактозидазой, но и индуцирует биосинтез этого фермента у некоторых бактерий. Например, если Е. coli в присутствии глюкозы, как единственного источника углерода, синтезирует только незначительные количества β-галактозидазы, то при наличии различных галактозидов образуется большое количество этого фермента (до 6...7 % всех содержащихся в клетке белков). Так, содержание лактозы в культуральной среде Е. coli в количестве 10-3 М индуцировало биосинтез фермента почти на 20%, а β-тиогалактозида в количестве 10-4 М на 80...100%.
В зависимости от источника происхождения оптимальными условиями для действия фермента являются pH 5,0...6,5 и температура 35...45 °С. Действие β-галактозидазы активируется АТФ и двухвалентными ионами металлов.
Катализируемый β-галактозидазой гидролиз лактозы до глюкозы и галактозы является начальной стадией гликолиза молока, в результате которого в дальнейшем через целый ряд последовательных реакций с участием различных ферментов из глюкозы образуется основной метаболит обмена веществ микроорганизмов – пировиноградная кислота. Пировиноградная кислота в зависимости от вида микроорганизма, а следовательно, и типа брожения (молочнокислое, спиртовое, маслянокислое, пропионовокислое, уксуснокислое и др.) превращается в целый ряд химических соединений. Галактоза слабо или не ферментируется и обычно, при участии УДФ-глюкозы, она переходит в глюкозо-1-фосфат, который после изомеризации в глюкозо-6-фосфат включается в процесс ферментации глюкозы.
Для молока наиболее характерным является молочнокислое брожение, при котором лактатдегидрогеназа катализирует обратимое восстановление пировиноградной кислоты в молочную. В гликолитическом процессе ферментации глюкозы молока при гомоферментативном молочнокислом брожении принимают участие 10 ферментов из гидрогеназ, фосфотрансфераз и изомераз. При этом гомоферментативные молочнокислые бактерии почти полностью превращают лактозу через пировиноградную кислоту в молочную – выход 98...99 %. Гетероферментативные молочнокислые бактерии продуцируют ферменты, необходимые для прямого окисления и декарбоксилирования промежуточных продуктов молочнокислого брожения. Вследствие их жизнедеятельности, кроме молочной кислоты, образуются этиловый спирт, уксусная кислота, диоксид углерода, диацетил, ацетоин и др. Таким образом, содержание важнейшего питательного компонента молока лактозы снижается, а повышается концентрация веществ, ухудшающих его органолептические свойства.
В коровьем молоке обнаружены активности α-маннозидазы (3.2.1.24) (рис. 18) и β-фруктофуронозидазы (3.2.1.26), имеющие в основном микробное происхождение. Однако α-маннозидаза является и нативным ферментом (из лизосом секреторных клеток молочной железы) и связана с казеином и ОШЖ. Активность α-маннозидазы составляет в среднем 0,043 Е/мл (≈ 0,72 нкат) при 50 °С (по Grün Е., 1985). Эти ферменты гидролитически отщепляют концевые нередуцирующие остатки α-D-маннозы в α-D-маннозидах и концевые нередуцирующие β-D-фруктофуранозидные остатки в βD-фрукто-фуранозидах соответственно. Биохимические свойства этих двух гликозидаз, как и β-глюкозидазы и роль их в молоке, изучены крайне недостаточно.
Содержащаяся в молоке N-ацетил-β-глюкозаминидаза (3.2.1.30) имеет как нативное, так и микробное происхождение. Основными источниками нативного фермента являются лизосомы, а по другим данным – эпиталиальные клетки секреторных клеток молочной железы и значительно меньше – соматические клетки, включая лейкоциты плазмы крови. Довольно активными продуцентами этого фермента являются бактерии рода Pseudomonas (рис. 18).
N-Ацетил-β-глюкозаминидаза в основном связана с сывороточными белками молока и небольшой процент приходится на связь этого фермента с мицеллами казеина или с ОШЖ.
В табл. 12 приведены данные по распределению активности N-ацетил-β-глюкозаминидазы в молоке коров голштинской породы и в сборном коровьем молоке ежедневно в течение 6 мес от 181 поставщика (Kitchen В. J., Middleton G. et al., 1984; Fox L. К., Hancock D. D., 1988):
Таблица 12
|
Фракция молока |
Активность, % по отношению к цельному молоку |
|
|
Молоко коров |
Сборное |
|
|
Обезжиренное молоко |
631) |
912) |
|
Жировая фракция |
≈ 221) |
… |
|
Оболочки шариков жира |
... |
22) |
|
Мицеллы казеина |
... |
72) |
|
Сывороточные белки |
… |
822) |
|
Соматические клетки |
От 7 до 131) 2) |
|
1) При центрифугировании цельного молока при 2700 g 10 мин при 5 °С, содержание жира в сливках 8 %.
2) При центрифугировании цельного молока при 300 g, в течение 30 мин при 5 °С.
Фермент выделен из молока довольно в чистой форме. Установлено, что нативная N-ацетил-β-глюкозаминидаза имеет две формы: низкомолекулярную А (кислая форма), молекулярная масса ≈ 14 000 Да, и высокомолекулярную – Б (щелочная форма), молекулярная масса ≈ 320 000 Да. Такие же формы обнаружены и для этого фермента из других источников.
N-Ацетил-β-глюкозаминидаза катализирует в молоке гидролиз гликопротеинов путем отщепления концевых нередуцирующих остатков 2-ацетамидо-2-дезокси-β-глюкозы. Оптимальным условием для действия фермента является температура 50 °С (40% активности сохраняется при 37 °С).
В целом, активность N-ацетил-β-глюкозаминидазы в сыром коровьем молоке составляет 0,0053 ед. (1 ед. соответствует количеству фермента, необходимого для образования 1 мкмоль n-нитрофенола/мин/мл молока при 37 °С). Отмечена активность этого фермента в пределах 0,008…0,037 Е/мл (≈ 0,13...0,62 нкат) при 50 °С (по Grün Е.). Ингибиторами фермента являются гепарин и N-ацетилглюкозамин в концентрации соответственно 159 ед. на 1 мл и 0,005 М (Mellors А.).
Величина активности N-ацетил-β-глюкозаминидазы в молоке имеет значение при обнаружении примеси анормального молока в цельном молоке (п. 2.2).
Ниже приведены другие гликозидазы, обнаруженные в молоке, и катализируемые ими реакции. Однако их происхождение и местоположение в молоке малоизвестно (по Grün Е., 1985; Kitchen В. J., 1985). По β-глюкуронидазе известно, что это фермент лизосомального происхождения и обнаруживается в молоке при заболевании коров маститом (Perdigon G., Medici М. et al., 1988).
|
Фермент |
Реакция |
|
α-Глюкозидаза (3.2.1.20) |
Гидролизует 1,4-связи концевого |
|
β-Глюкуронидаза (3.2.1.31) |
β-D-глюкуронозид + Н2О |
|
α-L-фукозидаза (3.2.1.51) |
α-L-фукозид + Н2О спирт + L-фукоза |
|
N-ацетил-β-глюкозаминидаза (3.2.1.51) (рис. 19) |
β-2-ацетамидо-2-дезокси-β-D-галактозид + Н2О |
Протеолитические ферменты (протеазы). Эти ферменты катализируют гидролитическое расщепление пептидных связей и в соответствии с номенклатурой ферментов подразделяются на пептидазы (экзопептидазы) и протеиназы (эндопептидазы).
В молоке имеются протеазы как нативного, так и микробного происхождения. Гидролиз белков включает 2 основные стадии:
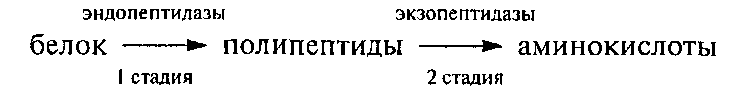
Источниками нативных протеаз в молоке являются протеазы, образующиеся в секреторных клетках молочной железы, протеазы плазмы крови, протеазы, принесенные кровью из других тканей организма, протеазы соматических клеток. К нативным протеазам молока относятся пептидазы (аминопептидазы, карбоксипептидазы), щелочные и кислые протеиназы.
Пептидазы. Из аминопептидаз, которые катализируют гидролиз полипептидов по месту пептидной связи, находящейся рядом со свободной аминной группой, т. е. от N-конца пептидной цепи азотистого соединения, в молоке обнаружены два фермента. Так, во фракции, полученной путем ультрацентрифугирования мицелл казеина при 300 000 g в течение 120 мин при 20 °С, выявлена ферментативная активность, которая обусловливается преимущественно наличием аминопептидазы, проявляющей специфичность к остаткам лизина и особенно лейцина и аланина. В соответствии с номенклатурой этим ферментом является цинксодержащая цитозоламинопептидаза (3.4.11.1), которая катализирует следующую реакцию:
![]()
Этот фермент катализирует гидролиз большинства L-пептидов и, кроме этого, проявляет и эстеразную активность. Оптимум pH фермента составляет 7,0...7,5. Активность фермента в коровьем молоке незначительна, составляя в среднем ≈ 0,02 Е (≈ 0,3 нкат) при 37 °С (по Grün Е., 1985). Сравнение относительной специфичности этого фермента молока и плазмы крови показывает их идентичность.
Микросомальная аминопептидаза (3.4.11.2) связана в основном с ОШЖ молока. Это подтверждается результатами исследований, показывающих, что удельная протеолитическая активность пахты выше, чем обезжиренного молока, а именно соответственно 2,36 и 0,06 Е/мг белка (Mangino М. Е., Brunner J. R., 1977). Эта аминопептидаза катализирует отщепление от пептидов и амидов α-аминокислоты (преимущественно аланин), но не пролин:
![]()
В коровьем молоке обнаружены невысокие активности – в среднем около 0,025 Е/мл (≈ 0,5 нкат) трипептидаминопептидазы (3.4.11.4) и дипептидазы (3.4.13.11) 0,012 Е/мл (≈ 0,20 нкат) при 37 °С (по Grün Е., 1985). Дипептидаза действуют на пептидные связи, рядом с которыми находятся одновременно свободные аминная и карбоксильная группы. Эти ферменты катализируют соответственно следующие реакции гидролиза дипептидов:
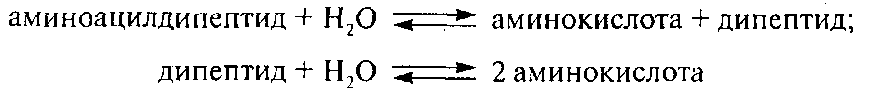
Из коровьего молока выделены и подвергнуты высокой степени очистки арилпептидиламидаза (3,4....) и γ-глутамилтранспептидаза (3.4....).
Арилпептидиламидаза из лактобацилл Lb. brevis и Lb. fermenti выделена, частично очищена и характеризована. Так, оптимумы рН и температуры для этого фермента составляют 6,5 и 35°С соответственно. Активность арилпептидиламидазы обнаружена и у Lb. casei, Lb. helveticus, Lb. bulgaricus, Lb. acidophils, Lb. buchneri. У фермента выявлена очень ограниченная специфичность, а именно только к двум субстратам – сукцинил-L-фенилаланин-4-нитроанилиду и глутарил-L-фенилаланин-4-нитроанилиду. Вместе с тем, отмечается активность к субстратам, содержащим пептидную связь (Soda М. El., Desmazeaud М. J., Zeyada N., 1981). Что касается γ-глутамилтранспептидазы, то в соответствии с номенклатурой она именуется как γ-глутамилтрансфераза (2.3.2.2), сведения о которой приведены в п. 1.4.
В целом, аминопептидазная активность обнаружена у многих микроорганизмов, которые свойственны сырому молоку (Otte J., 1982; Fox P. F., 1995), при этом грамотрицательные обладают более выраженной аминопептидазной активностью по сравнению с грамположительными (рис. 19).
К карбоксипептидазам относятся ферменты, которые катализируют гидролиз полипептидов по месту пептидной связи, находящейся рядом со свободной карбоксильной группой, т. е. от С-конца пептидной цепи азотистого соединения. В молоко они могут попасть из крови. Такими ферментами являются карбоксипептидазы А и Б (3.4.17.1 и 3.4.17.2). Как и аминопептидазы, это цинксодержащие протеины, с оптимумом рН ≈ 7,0.
Рис. 19. Сравнение между окрашиванием по Граму и реакцией на аминопептидазу бактерий
(n – число штаммов), выделенных из сырого коровьего молока (Otte J., 1982)
Эти ферменты катализируют следующие реакции, соответственно:
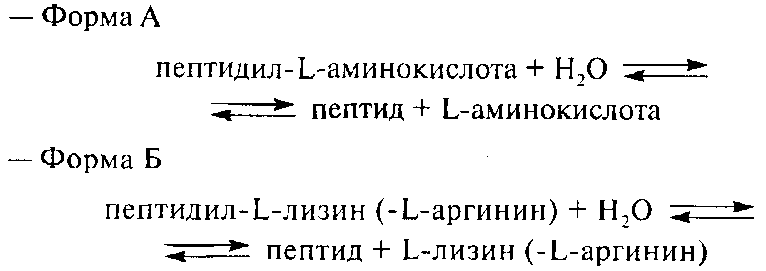
Амино- и карбоксилпептидазы стабилизируют ионы кальция, а ингибирует ЭДТК.
Протеиназы. Эти ферменты гидролизуют непосредственно белки. Наличие нативной протеиназы в коровьем молоке было впервые отмечено в работе Babcock S. M., Rusell H. L. (1897 г.). Затем S. Visser (1981 г) подтвердил наличие нативной протеиназы в молоке некоторых видов сельскохозяйственных животных.
Из коровьего молока выделены и получены в чистом виде две щелочные протеиназы: протеиназа I, свойства которой сходны с плазмином крови (3.4.21.7), и протеиназа II, свойства которой сходны с тромбином (3.4.21.5).
Эти ферменты являются основными нативными протеиназами молока и попадают в него из крови (Reimerdes Е. Н., 1983; и по Mottar J., Driessen F. M., 1987).
Впервые щелочная протеиназа из коровьего молока выделена в 1945 г, (Warner R. С, Polis Е.). В дальнейшем появилось много результатов исследований по использованию различных способов выделения и очистки с применением хроматографии, в том числе аффинной, что позволило получить высокоочищенный фермент с удельной активностью, превышающей в несколько сотен раз удельную активность этого фермента в исходном молоке (по Grufferty M. В., Fox Р. Е, 1988).
Протеиназы I и II связаны в основном с мицеллами казеина. При этом они непрочно связаны с β-казеином. Протеиназу I считают также и основным протеолитическим ферментом ОШЖ молока и связь фермента с ОШЖ очень прочная (по Grufferty M. В., Fox P. F., 1988).
Протеиназа I находится в молоке в основном в форме профермента – плазминогена (более 80 %) – предшественника плазмина, его неактивной формы, и в значительно меньшем количестве (в 5...8 раз) – в форме плазмина, активной формы фермента (Mottar J., Driessen F. M., 1987).
Установлено, что 93 % протеиназы I в форме плазмина связано с мицеллами казеина, в то время как эта величина для плазминогена составляет 70 %. При этом плазминоген менее прочно связан с мицеллами казеина. Концентрации плазмина и плазминогена в молоке, составляя 0,14...0,73 и 0,55...2,75 мкг/мл соответственно, обуславливаются зоотехническими факторами (п. 2.1) (De Rham О., Andrews А. Т., 1982; Richardson В. С, 1983). По данным Btnslimane S., Dognin-Bergeret M. J. et al. (1990 г.), среднегодовое содержание плазмина и плазминогена в сборном коровьем молоке от нескольких ферм и молочных предприятий составило 0,26 и 1,37 мкг/мл соответственно.
Выявлены заметные колебания содержания протеиназы I в молоке отдельных коров. Так, содержание фермента в молоке отдельных коров (общая бактериальная обсемененность – менее чем 1000 КОЕ/мл) составляет 0,80...2,75 мг/л, в сборном молоке – 1,33...1,74 мг/л. При этом содержание фермента в форме плазмина было соответственно 0,10...0,35 и 0,14...0,28 мг/л (Rollema H. S. Visser S., Poll J. К., 1983).
Протеиназа (I и II) является сериновым ферментом с трипсин-подобной активностью, в активном центре которой обнаружена следующая последовательность аминокислот: аспарагиновая – серин – глицин. Поскольку кровь содержит активаторы и ингибиторы плазминогена, то, следовательно, они имеются и в молоке. При этом активаторы плазминогена связаны с мицеллами казеина, а ингибиторы плазмина обнаружены в сывороточной фазе. Показано, что активатор плазминогена молока эквивалентен 0,5 Ploug ед. урокиназы (3.4.99.26) на мл и выдерживает тепловую обработку при 70°С в течение 10 мин, но теряет активность на 50% при 80°С в течение 10 мин (по Grufferty М. В., Fox Р. F., 1988).
Полагают, что содержание плазмина в молоке обусловлено действием активаторов на плазминоген в молочной железе. Кроме того, обнаружена слабая конверсия плазминогена в плазмин. На модельных системах показано, что некоторые виды Pseudomonas и Е. coli способны трансформировать плазминоген в плазмин в охлажденном молоке. Активирование плазминогена состоит в разрыве связи между двумя пептидами в его молекуле, и поэтому молекула плазмина состоит из двух цепей, одна из которых имеет молекулярную массу в 66...99 тыс. Да и связанная с ней другая цепь – с молекулярной массой 24...26 тыс. Да (по Driessen F. М., 1989).
В табл. 13 приведены данные по влиянию добавления урокиназы на повышение протеолитической активности сборного коровьего сырого и пастеризованного обезжиренного молока (полученного центрифугированием цельного молока при 1500 g в течение 10 мин) (De Rham О., Andrews А. Т., 1982).
Таблица 13
|
Добавки |
Молоко |
||
|
сырое |
пастеризованое |
||
|
72 °С, 18 с |
95 °С, 15 мин |
||
|
Протеолитическая активность, ед.1) |
|||
|
Без добавок (контроль) |
3,5 |
3,5 |
<1,0 |
|
Плазминоген, 100 мкг/мл |
4,0 |
6,5 |
2,0 |
|
Урокиназа, 50 мкг/мл |
9,5 |
9,0 |
2,0 |
|
Урокиназа, 50 мкг/мл + плазминоген, 100 мкг/мл |
17,0 |
15,0 |
9,5 |
Примечание. Продолжительность 24 ч при 37°С.
1) Произвольная единица.
Щелочная протеиназа I проявляют определенную специфичность по отношению к отдельным белковым фракциям молока. Так, если к αs1…αs4- и к-казеину она проявляется слабо, к α-лактальбумину и β-лактоглобулину практически не проявляется, то к αs2- и αs3-казеину она заметно выражена, β-казеин расщепляется протеиназой в 2...3 раза быстрее, чем в целом αs-казеин. Установлено, что в результате действия протеиназы I на β-казеин образуются С-концевые фрагменты – γ1-, γ2- и γ3-казеины и N-концевые фрагменты 5 и 8 компонентов протеозо-пептонной фракции. При гидролизе αs1-казеина отмечается образование трех фрагментов с молекулярной массой 20500, 12300 и 10 300 Да. Протеиназа I расщепляет пептидные связи с остатком лизина в большей степени, чем с остатком аргинина. Для протеиназы II, наоборот, отмечается большая специфичность к пептидным связям с остатками аргинина. Протеиназы могут расщеплять как внутренние, так и концевые пептидные связи в белках молока (по Jennes R., Walstra P., 1984; по Linden G., 1986).
Установлено, что протеозо-пептонная фракция молока состоит по крайней мере из 38 компонентов и сравнение ее с гидролизованными образцами казеинов щелочной протеиназы I показало, что 25 из них являются результатом гидролиза казеинов. При этом 52 % – в результате гидролиза β-казеина, 29% – αs1-казеина, 9 и 4% соответственно αs2- и к-казеина и 6% – в результате действия других протеиназ молока (по Grufferty M. В., Fox P. F, 1988).
Рис. 20. Влияние рН на активность протеиназы I и плазмина
(Reimerdes Е. Н. Halpaap I., Klastermeyer H.,1981):
1 – протеиназа I; 2 – плазмин
Активность щелочной протеиназы I в форме плазмина составляет для сборного молока 10...20 ед., в форме плазминогена – 83... 101 ед. и соответственно 7...26 и 49...166 ед. для молока отдельных коров (1 ед. соответствует количеству фермента, катализирующего гидролиз 0,1 ммоль н-D-валин-L-лейцин-L-лизин-4-нитро-анилида за 1 мин при 37°С) (Rollema H. S., Visser S., Poll J. К., 1983).
Установлено, что щелочная протеиназа I проявляет высокую активность при рН 6,5...9,0, достигая максимума при рН 7,5...8,0 (рис. 20). При этом отмечается совпадение зависимостей между величинами рН и активностями для молочной протеиназы I и плазмина крови, что подтверждает появление протеиназы I в молоке из крови. Оптимальной температурой действия щелочных протеиназ является 37 °С. Однако даже при такой достаточно низкой температуре, как 5°С, их активность составляет около 20 % активности при 37 °С (Dulley J. R.).
Ингибирование плазмина апротинином позволяет отметить, что примерно 20 % нативной протеиназной активности молока, определяемой с использованием нитроанилидовых субстратов, относится к щелочной протеиназе II и к кислой протеиназе.
Из молока выделена кислая протеиназа (3.4...) и изучены некоторые ее свойства (Noomen A.; Kaminogawa S., Yamauchi К., 1980). Молекулярная масса фермента составляет 36 000 Да. Он действует на пептидную связь между фенилаланином и лейцином. Специфичность кислой протеиназы молока к основным фракциям казеина подобна специфичности сычужного фермента (Fox Р. Е, 1981). Вместе с тем предполагают, что свойства кислой протеиназы сходны со свойствами катепсина D, который обнаружен в лизосомальных гранулах лейкоцитов (Kitchen В. J., 1985). Кислая протеиназа наиболее специфична к αs1-казеину, чем к цельному казеину и β-казеину, и малоспецифична к к-казеину, т. е. отличается от щелочной протеиназы. Достаточно высокую активность по отношению к αs1-казеину этот фермент проявляет при рН 5,2 и температуре 37 °С. Оптимальными величинами действия фермента являются температура, близкая к 50 °С, и рН около 4,0. Термоустойчивость кислой протеиназы несколько ниже по сравнению с щелочной протеиназой (гл. 3, с. 182).
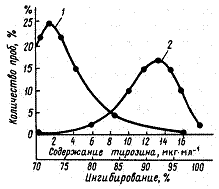
Рис. 21. Активность нативных протеиназ и ингибитора трипсина в сыром молоке
(Reimerdes E. H., Klastermeyer H.)
1 – активность нативных протеиназ, мкг тирозина/мл; 2 – активность ингибитора трипсина, %
Общая протеолитическая активность свежевыдоенного молока невысокая и выраженная, например, через концентрацию тирозина, образующегося при протеолизе, колеблется от 0,8 до 25 мкг/мл (в среднем 11,4 мкг/мл), а активность, выраженная в количестве небелкового азота, – от 0,8 до 4,5 %. Невысокая протеолитическая активность свежевыдоенного молока объясняется незначительной концентрацией нативных протеолитических ферментов, а также тем, что они находятся в неактивной форме, что в значительной степени может быть обусловлено наличием в молоке активаторов и ингибиторов протеаз. Активаторы протеиназы I обнаружены в казеиновой фракции молока, а ингибиторы – в сывороточной фракции (Korycka-Dahl M., Dumas В. R. et al., 1983; Reimerdes E. H., Klastermeyer H., Sayk E.). Ингибитором протеиназ является, например, соевый трипсиновый ингибитор (Ипатова О. М., 1988).
На рис. 21 показано влияние такого ингибитора на протеолитическую активность молока. При добавлении к сырому обезжиренному молоку соевого трипсинового ингибитора в количестве 1,0 мг/мл протеолитическая активность этого молока снижалась с 3,5 до 1 ед., а при использовании дополнительно активатора – урокиназы в количестве 50 мкг/мл молока – с 9,5 до 1,0 ед. (De Rham О., Andrews А. Т., 1982).
Ингибирующее действие на протеиназы оказывает также β-лактоглобулин (β-Лг) и α-лактальбумин (α-Ла) молока, о чем свидетельствуют приведенные в табл. 14 данные (Hayes М. G., McSweeney P. L. Н., Kelly A. L., 2002).
Таблица 14
|
Ингибитор1) |
Протеозо-пептонная фракция, |
|
|
0,109 ммоль |
0,219 ммоль |
|
|
β-Лактоглобулин: |
||
|
нативный |
67,5 |
50,0 |
|
денатурированный |
45,2 |
24,9 |
|
α-Лактальбумин: |
||
|
нативный |
64,1 |
34,6 |
|
денатурированный |
41,3 |
23,5 |
1) Добавление β-Лг и α-Ла к β-казеину, инкубированному с плазмином (активность 0,0304 Е/мл) при 37 °С в течение 4 ч.
Сильными ингибиторами протеиназ молока являются плазма крови и соли тяжелых металлов (меди, цинка, ртути и железа). Среди активаторов этих ферментов следует отметить ионы кальция, хлорид натрия (в концентрации 1...3 %) и глицерин.
На общую протеолитическую активность сырого обезжиренного молока (полученного при центрифугировании сборного цельного молока коров при 2000 об./мин в течение 10 мин) влияет добавление некоторых витаминов и перекиси водорода. Так, добавление аскорбиновой кислоты в количестве до 0,2 мг/100 мл или перекиси водорода – до 1,5 мг/100 мл усиливало протеолиз молока на 38 и 28 % соответственно. Однако, при увеличении концентрации этих веществ степень влияния снижалась (Igarashi Y., 1990).
Протеазы микробного происхождения, как липазы и лактазы, относятся к экзоферментам, при участии которых высокомолекулярные белковые компоненты молока подвергаются гидролизу с образованием различных азотсодержащих соединений, используемых в процессах обмена веществ клетки (Fox Р. Е, 1995). Экзопротеазы появляются в молоке уже в начальные фазы роста микроорганизмов. В дальнейшем микробная протеолитическая активность молока возрастает параллельно клеточной популяции и достигает максимума перед средним этапом стационарной фазы роста микроорганизмов.
Протеолитическая активность молочнокислой микрофлоры как основного вида микроорганизмов сырого неохлажденного молока в целом относительно невысока. При этом большей экзоклеточной активностью, как протеиназной, так и пептидазной, обладают молочнокислые палочки. Для лактококков в основном характерна протеиназная активность, и только некоторые, например L. lactis, обладают и пептидазной активностью. Установлено, что по способности гидролизовать казеин лактококки, например, располагаются в порядке уменьшения следующим образом: L. cremoris, Str. thermophilus, L. lactis, L. diacetilactis, L. paracitrovorus. При этом мезофильные лактококки образуют больше растворимых белковых соединений (в 1,5…2,0 раза), чем термофильные стрептококки, стрептобактерии и термобактерии. По количеству небелковых азотистых соединений, в том числе свободных аминокислот, образованных в результате метаболизма, лактококки образуют в порядке убывания следующий ряд: Str. thermophilus, L. cremoris, L. lactis, L. diacetilactis, L. paracitrovorus. Молочнокислые палочки, особенно термофильные, обладающие более активными пептидазными системами, вызывают более глубокий гидролиз казеина молока до аминокислот. В целом молочнокислые палочки более специфичны к β-казеину. Установлено, что протеиназы молочнокислых палочек Lb. helveticus, Lb. paracasei и Lb. bulgaricus имеют молекулярную массу в пределах 135 000…180 000 Да и оптимальными условиями действия их являются рН 6...7 и 35...50°С. Они являются ферментами серин- или цистинового типа. Отмечено, что казеинолитическая активность Lb. bulgaricus обусловлена двумя видиами протеиназ – одной цинк-содержащей и теплолабильной и другой – кальций-зависимой и теплоустойчивой. Пептидазы этих трех видов молочнокислых палочек, как экзо-, так и эндоклеточные, участвуют в гидролизе казеина. Молекулярная масса пептидаз находится в пределах 87 000...96 000 Да; оптимумы pH - 6,5...7,0 и 37...55°С (Vesanto Е., 1996).
Проведены многочисленные исследования по способности молочнокислых бактерий расщеплять белки молока и накапливать свободные аминокислоты (И. В. Ветрова, В. И. Звягинцев, Э. Е. Грудзинская, А. К. Максимова; В. П. Шидловская, П. Ф. Дьяченко; El Soda М. Е., Desmazeaud М. J., Zeyada N.; Umemoto Y., Itoh H.; Sorhang T., Kolstad J.; Exterkate F. A., 1981; Cichosz G., 1995; Maret R., Sorri T. et al., 1995; и др.). Отмечена достаточно высокая корреляция между гликолитической и протеолитической активностями молочнокислых бактерий при развитии их в молоке.
Многочисленными исследованиями показано, что психрофильные бактерии, составляя значительную часть микрофлоры сырого охлажденного молока, привлекают все возрастающее внимание благодаря способности продуцировать термостабильные протеолитические ферменты. Ферменты некоторых психрофилов выделены из молока, очищены и частично охарактеризованы, некоторые из них получены в кристаллической форме. Наибольшее число исследований посвящено экзопротеазам Pseudomonas. Молекулярная масса этих ферментов составляет 23000...77000, но в основном находится в пределах 40000...50000 Да (Fox P. F, 1981; Mitchell S., Marshall R., 1989). В основном они являются металлопротеазами, содержат цинк и кальций или только цинк, при этом кальций стабилизирует конформацию молекулы фермента. Так, например, протеиназы Ps. fluorescens и Serratia marcecens, выделенные из сырого молока, содержат 0,7...1,1 моль цинка/моль фермента и 5,8...8,4 моль кальция/моль фермента. Кроме того, протеиназы Ps. fluorescens содержат 0,03...0,23% углеводов (Mitchel G. Е., Ewings К. N., 1986).
В зависимости от вида Pseudomonas, например Ps. putrefaciens, fluorescens, myxogens, aeruginosa, fragi, maltophilia и другие протеазы, имеют различия по свойствам, оптимуму pH и температуры, молекулярной массе, ингибиторам, активаторам и термоустойчивости. По аминокислотному составу экзопротеазы видов Pseudomonas характеризуются наибольшим содержанием аспарагиновой и глутаминовой кислот, треонином, аланином, серином и глицином и наименьшим – метионином, гистидином, аргинином и, практически, отсутствием цистина (Fairbairn D. J., Law В. А., 1986).
Оптимальный pH для проявления активности протеиназ Pseudomonas равен 6,5...8,0 (отдельные виды – до pH 10), в том числе для Ps. fluorescens оптимум pH 7,0, но при pH 4,7 и 9,0 активность фермента составляет еще 67 % активности при оптимальном pH. При pH 6,6, свойственном цельному молоку, активность этих ферментов проявляется на 90 %. Например, при использовании в качестве субстрата цельного казеина Ps. fluorescens проявляет оптимальную протеиназную активность при pH 6,5; при pH 5,0 и 8,0 эта активность снижается на 30 % от величины максимальной активности. Изоэлектрическая точка ферментов находится в пределах pH 5,1...8,25.
Оптимальная температура для действия протеиназ Pseudomonas в основном равна 37...45°С. Вместе с тем имеются наблюдения, что Ps. fluorescens и Ps. fragi достаточно протеолитически активны при 8, 20 и 25 °С. Зависимость от температуры особенно выражена при использовании штаммов, продуцирующих большое количество ферментов. Ингибиторами протеиназ Pseudomonas являются, например, ЭДТК, тиоловые реагенты и ионы некоторых тяжелых металлов, а активаторами – ионы марганца, магния, кальция, цинка, кобальта, бария и железа (по Fox Р. F., 1981; Fairbairn D. J., Law В. A., 1986; Mitchell S., Marshall R., 1989).
Микробные протеолитические ферменты проявляют заметную активность по отношению к казеину, сывороточные белки расщепляются ими в меньшей степени (Gallmann Р., Puhan Z., 1982). При этом большая специфичность проявляется к к- и β-казеину, чем к αs1-казеину. В табл. 15 представлены данные по специфичности протеиназ различных штаммов Pseudomonas, выделенных из сырого молока, к отдельным фракциям казеина и сывороточным белкам (Adams D. М., Barach J. Т, Speck М. L.).
Таблица 15
|
Белок |
Продолжи- |
Степень гидролиза, % |
|
|
Пределы |
Основные |
||
|
к-казеина |
7 |
29...56 |
36...56 |
|
β-казеина |
7 |
24...80 |
40...80 |
|
αs- казеина |
7 |
5...80 |
23...80 |
|
α-лактальбумина |
13 |
0...36 |
10...36 |
|
β-лактоглобулина |
13 |
0...39 |
– |
1) Число штаммов Pseudomonas – 9. Первоначальная популяция штаммов составляла около 106 или 103 КОЕ/мл сырого обезжиренного молока.
Протеолитические ферменты микробного происхождения по структуре в ряде случаев отличаются от нативных протеолитических ферментов молока, но по способности связывать субстрат и по своим каталитическим свойствам они функционально идентичны (Фёршт Э., 1980).
В табл. 16 приведены результаты исследований протеолитической активности микрофлоры сырого молока. Почти 50% бактериальных штаммов характеризуется очень высокой, высокой и средней активностью. Флуоресцентные штаммы Pseudomonas, штаммы Flavobacterium и Alcaligenes характеризуются наиболее высокой протеолитической активностью. По данным Е. А. Моисеевой и Л. А. Мишучковой, из 65 изученных штаммов психрофильных бактерий сырого молока около 22% обладали заметной протеолитической активностью (основной состав микрофлоры: Pseudomonas ≈ 40 %, Achromobacter ≈ 40 % и Alcaligenes ≈ 15 %).
Таблица 16
|
Микроорганизмы |
Количество штаммов в сыром молоке, % |
||||
|
с установленной протеолитической |
неактивных |
||||
|
очень |
высокой |
средней |
слабой |
||
|
Pseudomonas: |
|||||
|
нефлуоресцентные |
4 |
7 |
24 |
11 |
54 |
|
флуоресцентные |
35 |
22 |
11 |
8 |
25 |
|
Enterobacteriaceae, Aeromonas, Pasturella или Vibrio |
9 |
18 |
10 |
5 |
58 |
|
Acinetobacter, Moraxella или Brucella |
7 |
7 |
37 |
0 |
49 |
|
Chromobacterium |
17 |
11 |
6 |
6 |
61 |
|
Flavobacterium |
6 |
36 |
23 |
13 |
23 |
|
Alcaligenes |
23 |
54 |
15 |
0 |
8 |
|
Грамположительные |
2 |
11 |
3 |
2 |
83 |
Примечание. Активность штаммов определяли на агаре с обезжиренным молоком путем подсчета ширины зоны просветления вокруг колонии после 7 и 14 дней инкубации при 6 °С: очень высокая активность – зона более 10 мм (7 дней); высокая активность – зона 10 мм (14 дней); средняя активность – зона 1...10 мм (14 дней); слабая активность – зона менее 1 мм (14 дней).
Таким образом, психрофильные бактерии молока обладают довольно высокой активностью большой группы экзоферментов, а именно: оксидаз, липаз, фосфолипаз, гликозидаз, аминопептидаз и протеиназ. Совместное действие этих ферментов способствует более активным процессам изменения нативного состояния молока (окисление, гликолиз, липолиз, протеолиз), а следовательно, и изменению его качественных показателей.
Имеется сообщение о том, что лактоферрин женского молока является сериновой протеазой, катализирует гидролиз белков, богатых аргинином (Hendrixon D. R., Qiu J., Shewry S. С. et al., 2003). Можно предположить, что и лактоферрин коровьего, а возможно и других видов молока, является нативным протеолитическим ферментом. Следует также отметить, что лактоферрин коровьего молока обладает, наряду с лизоцимом, бактериостатическим действием к некоторым видам бактерий, например к Е. coli, и, кроме того, он усиливает бактерицидное действие лизоцима.
Лактоферрин коровьего молока – это железосвязывающий гликопротеин, который по структуре и функциям идентичен трансферрину крови, но несколько отличается от него аминокислотной последовательностью и молекулярной массой 76 500 и 80 000 Да соответственно и синтезируется в клетках молочной железы. Лактоферрин выделен из коровьего, буйволиного и кобыльего молока, и установлена его трехмерная структура. Полипептидная цепь его состоит примерно из 690 остатков аминокислот и сложена в 2 крупные доли, в каждой из которых есть один участок для связывания железа. Кроме того, лактоферрин образует стабильные комплексы с ионами и других металлов (Al, Cr, Со и Сu). В молоке 6...8% лактоферрина насыщено железом. Свободное железо и его соединения катализируют образование свободных радикалов, поэтому лактоферрин считается общим антиоксидантом (Горбатова К. К., 2004; Бейкер Е. Н. и др., 2006). Установлено, что лактоферрин обладает и некоторой рибонуклеазной активностью. Содержание лактоферрина в коровьем молоке составляет 0,02...0,35 мг/мл, при этом в начале и конце лактации его содержание увеличивается до 1,9 мг/мл.
Другие гидролазы. К другим гидролазам помимо эстераз, гликозидаз и протеаз относятся ферменты, которые действуют на С–N-связи в линейных амидах (подкласс 3.5.).
Уреаза (3.5.1.5) катализирует гидролиз мочевины с образованием аммиака:
![]()
Уреаза представляет собой никельпротеин, о ее происхождении и местонахождении в молоке неизвестно. Вместе с тем, этот фермент вообще широко распространен у микроорганизмов. Например, среди молочнокислых бактерий имеются как уреазоположительные, так и необразующие уреазу (Храмов В. А., 2000). Кроме того, содержание мочевины в сборном сыром молоке составляет 15...40 мг/% (Шидловская В. П., 1982 и 1987). Поэтому в молоке для действия уреазы имеется в достаточном количестве субстрата – мочевины.
К гидролазам молока, действующим на С-N-связи в линейных амидинах, относятся аргиназа и аргининдеиминаза.
Аргиназа (3.5.3.1) имеет как нативное, так и микробное происхождение. Наличие аргиназы в молочной железе не только установлено, но и отмечаются адаптивные изменения ее активности и свойств в зависимости от уровня синтеза компонентов молока в молочной железе. Аргиназа катализирует гидролиз L-аргинина с образованием мочевины:
![]()
Следует отметить довольно высокую специфичность фермента.
При хранении молока в условиях, способствующих развитию микрофлоры, наличие аргиназы, являясь, с одной стороны, причиной возможно повышенного содержания в нем мочевины, т. е. увеличения небелковых азотистых веществ, ухудшающих его технологические свойства, с другой стороны, служит источником возможного образования в молоке аммиака под действием уреазы и других ферментов.
Аргининдеиминаза (3.5.3.6). О происхождении фермента и местонахождении его в молоке данных не имеется. Вместе с тем, имеются данные о продуцировании этого фермента некоторыми санитарно-показательными микроорганизмами (например, Enterobacter и Proteus), а также некоторыми молочнокислыми бактериями. Аргининдеиминаза катализирует, как и аргиназа, гидролиз L-аргинина, но с образованием аммиака:
![]()
Таким образом, в результате проявления активности урезы и аргининдеиминазы, наряду с каталитической активностью ксантиноксидазы, нитритредуктазы, а также триптофаназы (см. п. 1.6), содержание аммиака в сыром молоке может превысить его естественный уровень – в среднем 0,5 мг% (Zangeri Р., Ginzinger W., 1986). Содержание аммиака более 0,8 мг% свидетельствует о заметном микробном обсеменении молока (Шидловская В. П., 1985).
В коровьем молоке обнаружена активность аденозиндеаминазы (3.5.4.4), которая действует на С–N-связи в циклических амидинах. Этот фермент катализирует окислительное дезаминирование рибонуклеозидаденозина в инозин. Ее активность в молоке составляет в среднем за год (296,5 ± 82,1) мЕ/л (при 37 °С). Активность этого фермента используют для идентификации различных режимов тепловой обработки молока (п. 3.1) (Martin D., Kiesner С. et al., 1998).
Тиаминаза (3.5.99.2) действует на С–N-связи в других соединениях, чем указанных в подклассе 3.5, и катализирует гидролиз тиамина, что является причиной снижения биологической ценности молока:
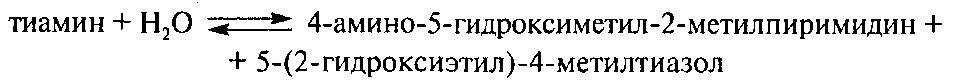
В коровьем молоке выявлена активность некоторых гидролаз, которые действуют на дифосфатные связи в ангидридах кислот. Эти ферменты в основном нативного происхождения, их источником является плазмалемма секреторных клеток молочной железы, и обнаруживаются они в ОШЖ молока. К ним относятся аденозинтрифосфатаза и АТФ-пирофосфатаза.
Аденозинтрифосфатаза (3.6.1.3) (АТФ-аза). Фермент одинаково катализирует гидролиз ЦТФ, ГТФ, УТФ и АТФ. Так, при гидролизе АТФ образуется АДФ и ортофосфат; АТФ-пирофосфатаза (3.6.1.8) (АТФ-аза) катализирует также гидролиз АТФ, но с образованием АМФ и пирофосфата. Установлено, что в 1 л молока содержится в среднем 0,2 мкмоля АТФ, при этом хорошим источником его являются мицеллы казеина (0,13...0,31 мкмоль/л). Оптимум действия указанных фосфатаз составляет рН – около 8,5 при 55 °С. Специфичность действия этих ферментов невысокая. Активаторами этих двух фосфатаз являются ионы магния. Для субстрата АТФ Км в присутствии 5 ммоля магния составляет 5,68 • 10-5 М (Kitchen В. J, 1985).
Активность АТФ-пирофосфатазы в молоке по количеству образованного неорганического фосфора может достигать 12 мг%. Таким образом, эти ферменты наряду с другими фосфатазами являются источниками жизненно важного неорганического фосфора.
Другими фосфатазами молока являются неорганическая пирофосфатаза (3.6.1.1.) и нуклеотидпирофосфатаза (3.6.1.9).
Полагают, что они связаны с оболочками шариков жира (ОШЖ) молока. Эти ферменты катализирует следующие реакции гидролиза соответственно:
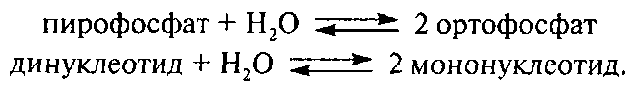
[1] 3.1.1.1 – здесь и далее по классу гидролаз: первое число означает класс фермента; второе число означает тип гидролизуемой связи; третье число уточняет тип гидролизуемой связи в субстрате и четвертое число – порядковый номер фермента в его подподклассе.
[2] 1 ед. активности соответствует количеству фермента, которое в течение 1 ч изменяет степень поглощения на 1 ед. между супернатантом (полученном при центрифугировании молока при 12000 g в течение 15 мин), инкубированном при 45 °С и контролем. Поглощение растворимых нуклеотидов в супернатанте измеряли при 260 нм.







