Трансферазы – это ферменты, которые осуществляют перенос различных химических групп от субстрата к акцептору. В зависимости от вида химической группы природа кофермента трансфераз различна. Число ферментов этого класса, а именно некоторые из ацил-, аминоацил-, гексозил-, амино-, фосфо- и сульфидтрансфераз, в молоке достигает 20. Трансферазы играют важную роль в обмене веществ клеток молочной железы, в основном, являются нативными ферментами молока.
Ацилтрансферазы. В молоке в качестве составляющей полиферментного комплекса пируватдегидрогеназы (1.2.4.1.) находится дигидролипоамидацетилтрансфераза (2.3.1.12), которая катализирует следующую реакцию:
![]()
Аминоацилтрансферазы. В молоке обнаружены γ- и D-глутамилтрансферазы.
γ-Глутамилтрансфераза (2.3.2.2)[1] является нативным ферментом. Его источником служит плазмалемма секреторных клеток молочной железы.
γ-Глутамилтрансфераза выделена из оболочек шариков жира молока. Молекула фермента состоит из двух субъединиц (димер) с молекулярной массой 57 000 и 25 500 Да. Обе субъединицы представляют собой гликопротеины. Доказано сходство кинетических характеристик очищенного фермента, выделенного из молока и ткани лактирующей молочной железы (Baumrucker C.R., 1980). Фермент имеет три изоформы. Оптимальные рН и температура – 8...9 и 45 °С соответственно. Изоэлектрическая точка – при рН 3,85.
Ниже приведены данные по относительному распределению активности γ-глутамилтрансферазы в различных фракциях молока.
|
Анализируемый образец |
Распределение активности фермента[2], % |
|
Сырое цельное молоко |
100 |
|
Обезжиренное молоко (центрифугирование молока |
74,3 |
|
Казеин (осадок после центрифугирования обезжиренного |
18,4 |
|
Сыворотка (супернатант после центрифугирования |
53,8 |
|
молочная сыворотка (супернатант после центрифугирования |
12,8 |
|
оболочки шариков жира (в осадке после |
41,3 |
|
Сливки (жир 35 % – после центрифугирования молока) |
23,2 |
|
пахта (после замораживания и оттаивания сливок при 40 °С) |
18,3 |
|
оболочки шариков жира (в осадке после центрифугирования пахты при 120 000 g в течение 30 мин при 4°С) |
6,6 |
Отмечают, что γ-глутамилтрансфераза относительно непрочно связана с ОШЖ молока. Следовательно, при механическом воздействии на молоко возможен значительный переход этого фермента в водную фазу молока.
γ-Глутамилтрансфераза осуществляет перенос ацильной группы на пептид:
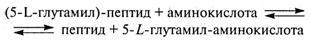
Фермент участвует в аминокислотном транспорте при лактации коров, катализируя перенос остатка γ-глутамила из глутатиона или других компонентов на аминокислоты или пептиды. Располагаясь на внешней поверхности секреторных клеток молочной железы, γ-глутамилтрансфераза играет важную роль в переносе аминокислот из крови в секреторную клетку для использования в синтезе белков молока.
Активность фермента в молоке непостоянна. Так, например, в молоке коров чешской красно-пестрой породы она составляет 16,5...72,0 ед. (1 ед. соответствует количеству фермента, вызывающего образование 1 мкмоль продукта в течение 1 ч при 37 °С). Отмечают прямую зависимость между содержанием жира и активностью этого фермента в молоке. Ингибиторами фермента являются ионы меди и железа. Лактоза и лимонная кислота слегка ингибируют фермент, а хлориды кальция, магния и калия, фосфат натрия, протеозо-пептонная фракция молока практически не влияют на него (Majumder G. С, Ganguli N. С., Kitchen В. J., 1985).
D-Глутамилтрансфереза (2.3.2.1) по происхождению и связи с ОШЖ молока подобна γ-глутамилтрансферазе. Она также осуществляет перенос ацильной группы, но по другому уравнению:
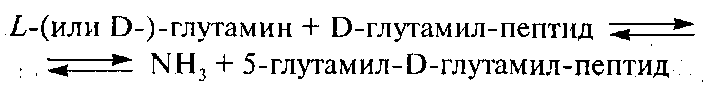
Таким образом, γ- и D-глутамилтрансферазы участвуют в перегруппировке небелковых азотистых веществ, а D-глутамилтрансфераза дополнительно может быть причиной повышения содержания в молоке аммиака.
Белок-глутамин-γ-глутамилтрансфераза (2.3.2.13) (трансглутаминаза). Этот фермент имеет нативное и микробное происхождение и подобно γ- и D-глутамилтрансферазам катализирует реакцию переноса ацильной группы, но с созданием ковалентно-поперечной связи между белками с образованием высокомолекулярных полимеров.
![]()
Трансглутаминаза выделена из молочной железы и некоторых бактерий с достаточной степенью очистки (Kuraishi С., Yamazaki К., Susa Y., 2001). Из обезжиренного коровьего молока выделен ингибитор этого фермента, который обнаружен также в овечьем и козьем молоке (De Jong G. А. Н., Wijngaards G., Koppelman S. J., 2003).
Гексозилтрансферазы. Из этого подкласса, осуществляющих перенос гликозильных групп, в молоке обнаружены некоторые ферменты.
Лактозосинтаза (2.4.1.22) (галактозилтрансфераза) является нативным ферментом (первое сообщение появилось в 1964 г.) и катализирует синтез лактозы в секреторных клетках молочной железы. По данным В. Ярмоленко и В. Вайткуса (1982), механизм регуляции образования лактозосинтазы включает α-лактальбульмин и как дополнительный компонент – ионы кальция.
Лактозосинтаза обнаружена в мембранах частиц аппарата Гольджи молочной железы. Она выделена из молока и хроматографически разделена на две фракции – А (гликопротеин-4-β-галактозилтрансфераза 2.4.1.38) и Б (α-лактальбумин). Точное количественное содержание ее в молоке не установлено, полагают – 0,3...0,4 мг%. Молекулярная масса лактозосинтазы составляет около 43 000 Да. Удельная активность очищенной фракции А фермента составляет 14 мкмоль/мин/мг белка при 37°С и нейтральном рН, а активность в молоке – 0,040...0,060 Е/мл (~ 0,67...1,0 нкат). Лактозосинтаза получена в кристаллической форме (см. рис. 13).
Лактозосинтаза содержит 12...13 % карбогидрата, состоящего из ≈ 8% нейтральных сахаров, 1 % глюкозамина, 1 % галактозамина и 2 % сиаловой кислоты. Показано, что трипсин или плазмин расщепляют молекулу фермента до 42 000 Да и действие плазмина после секреции молока является вероятно причиной нахождения фермента в молоке с такой молекулярной массой (Jennes R., Walstra R, 1984).

Рис. 13. Кристаллическая форма лактосинтазы коровьего молока х750 (по Диксон М., Уэбб. Э., 1982)
Лактозосинтаза осуществляет перенос галактозильной группы от УДФ-галактозы на глюкозу:
![]()
В отсутствие α-лактальбумина фермент катализирует перенос галактозы с УДФ-галактозы на N-ацетилглюкозамин, что происходит при синтезе гликопротеинов и олигосахаридов молока. Оптимальными условиями его действия являются рН 7,5 и температура 37...42°С. Активаторами фермента служат ионы марганца (в небольших концентрациях), ингибиторами – ионы марганца, магния и фосфаты (высокие концентрации).
В табл. 4 приведены гексозилтрансферазы, обнаруженные в молоке, которые используют другие субстраты и акцепторы гликозильных групп. Некоторые из них выделены из молока и их свойства изучены, но сведения об их происхождении и местонахождении в молоке практически отсутствуют (Kitchen В. J. 1984; Grün Е., 1985).
Таблица 4
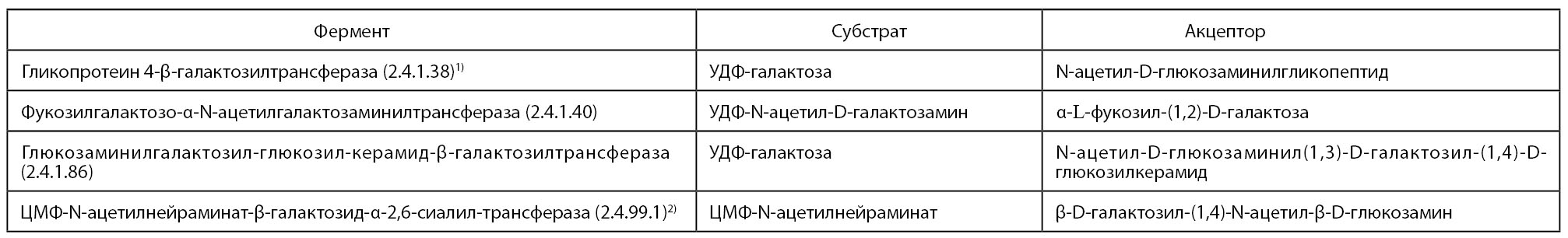
1) Компонент лактозосинтазы.
2) Переносит другие гликозильные группы, чем ферменты под №№ 2.4.1.38, 2.4.1.40 и 2.4.1.86.
Аминотрансферазы. Эти ферменты осуществляют перенос азотистых групп, а именно аминогрупп с аминокислот на кетокислоты. Реакции, катализируемые аминотрансферазами (или трансаминазами), носят название «транспереаминирование». Многие ферменты из аминотрансфераз играют большую роль в процессах синтеза и распада аминокислот в молочной железе. Наиболее активны в этом отношении аспартат- и аланинаминотрансферазы.
Аспартатаминотрансфераза и аланинаминотрансфераза (2.6.1.1 и 2.6.1.2) в молоке имеют как нативное происхождение, попадая в него из секреторных клеток молочной железы (источником служит цитоплазма), так и микробное. Источником этих ферментов в молоке является и плазма крови. Более 83 и 100% ферментов соответственно было обнаружено в молочной сыворотке.
Аспартат и аланинаминотрансферазы представляют собой ПФ-протеины. Путем переноса аминогрупп они катализируют следующие реакции транспереаминирования:
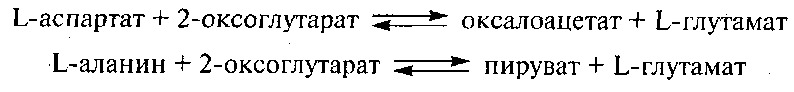
Имеются данные, что активность аспартатаминотрансферазы в молоке составляет 14,64 ед., а аланинаминотрансферазы – 8,33 ед. (1 ед. соответствует количеству фермента, вызывающего превращение 1 мг аминокислоты в 100 мл обезжиренного молока за 1 ч при 37 °С). По данным Sonneck R. (1979), активность этих ферментов в коровьем молоке невысока и составляет 0,010...0,030 Е/мл (~ 0,17...0,50 нкат).
Фосфотрансферазы (фосфокиназы). Эти ферменты катализируют перенос фосфорсодержащих групп. Реакции протекают с участием АДФ и АТФ, и таким образом происходит перенос энергии с одной системы на другую.
В молоке имеется несколько фосфотрансфераз нативного и микробного происхождений (микроорганизмы, сбраживающие лактозу). На нативное происхождение этих ферментов в молоке указывает наличие их в цитоплазме секреторных клеток молочной железы (Грачев И. И., Попов С.М., Скопичев В. Т.).
Из фосфотрансфераз в молоке обнаружены: глюкокиназа (2.7.1.2), галактокиназа (2.7.1.6), 6-фосфофруктокиназа (2.7.1.11), рибофлавинкиназа (2.7.1.26), глицеролкиназа (2.7.1.30) и пируваткиназа (2.7.1.40), которые в качестве акцептора используют спиртовую группу; фосфоглицераткиназа (2.7.2.3), использующая в качестве акцептора карбоксильную группу.
В табл. 5 приведены реакции, катализируемые этими фосфотрансферазами.
Таблица 5

Эти ферменты принимают участие в ключевых реакциях гликолиза бактериальных клеток до образования пировиноградной кислоты вслед за первой стадией гликолиза молока – расщепления лактозы лактазой на D-глюкозу и D-галактозу. Реально наличие в молоке и протеинкиназы (2.7.1.37) (казеинкиназа), катализирующей фосфорилирование казеина в эндоплазматическом ретикулуме и компонентах аппарата Гольджи секреторных клеток молочной железы (Bingam Е. V., 1979), которое происходит следующим образом:
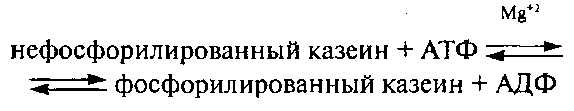
Нуклеотидилтрансферазы. Из этих трансфераз отмечено наличие в молоке ФМН-аденилтрансферазы (2.7.7.2), которая катализирует реакцию:
![]()
Другие сведения об этом ферменте молока отсутствуют.
Сульфиттрансферазы. Из этих ферментов в молоке обнаружена только тиосульфатсульфиттрансфераза (2.8.1.1) (роданаза). Первое сообщение об этом ферменте отмечено в 1933 г. Происхождение ее в молоке неизвестно. Фермент катализирует реакцию переноса групп, содержащих серу, в результате которой образуется тиоцианат, являющийся одним из факторов, обусловливающих действие лактопероксидазо-антибактериальной системы молока (субстратом могут служить и другие соединения, содержащие серу):
![]()
Активность тиосульфатсульфиттрансферазы в молоке обычно составляет 0,034 Е/мл (≈ 0,6 нкат).
[1] 2.3.2.2 – здесь и далее по классу трансфераз первое число означает класс фермента; второе число указывает на природу переносимой группы; третье число означает тип переносимой группы (в подклассе 2.7 третье число указывает на природу акцептора); четвертое число – порядковый номер фермента в его подподклассе.
[2] За единицу активности фермента принято образование 1 мкмоль n-нитроанилида в 1 мин при 37°С.







