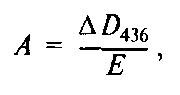Качественный метод определения общей активности редуктаз (дегидрогеназ). Сущность метода. Визуальное фиксирование изменения окраски смеси молока с индикатором после выдерживания ее в течение определенного промежутка времени и температуры. Проведение анализа при 37 °С оказывает благоприятное воздействие на обмен веществ не всех групп бактерий. Поэтому имеются рекомендации о проведении анализа при 30 °С, так как при этой температуре развивается более широкая группа микрофлоры и, следовательно, активность редуктаз в молоке будет выше. Многие исследователи установили, что для повышения биохимической активности микрофлоры в случае анализа молока глубокоохлажденного (до 4°С и ниже), в холодное время года или в случае быстрой доставки молока (не более 12 ч с момента доения), необходимо пробы молока перед проведением анализа выдержать от 12 до 24 ч.
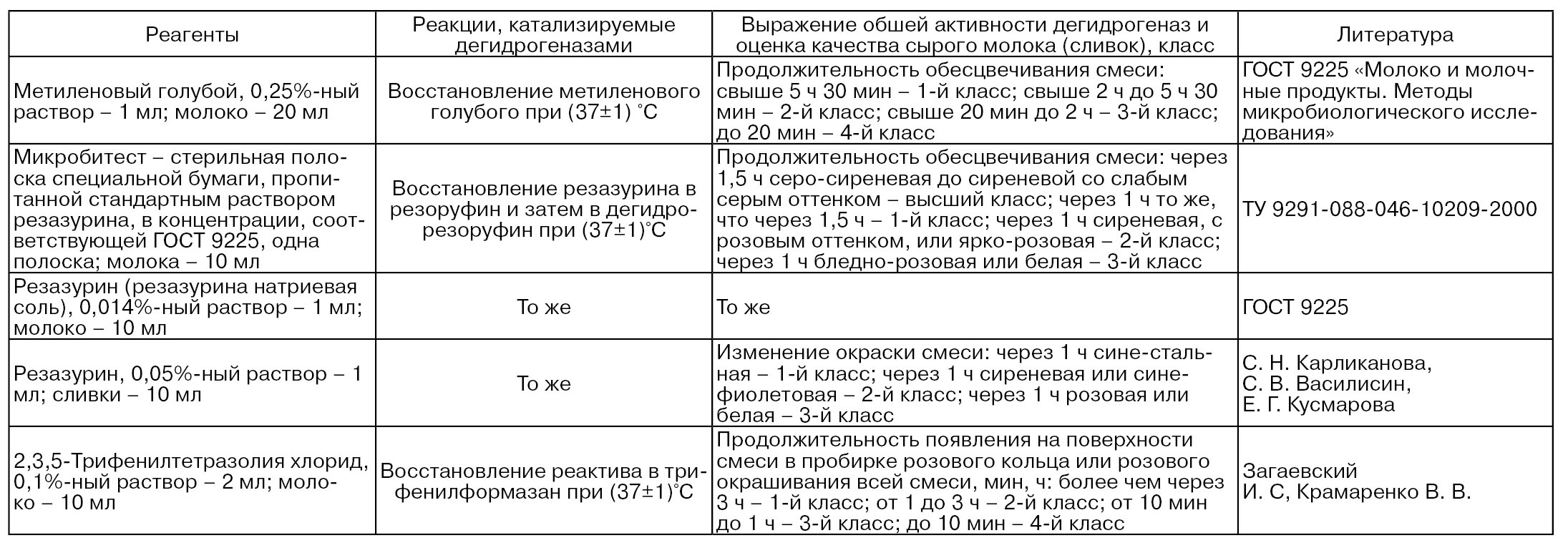
В табл. 73 приведены основные характеристики визуальных качественных методов определения общей активности редуктаз в сырых молоке и сливках.
Количественный метод определения общей редуктазной активности. Сущность метода. Колориметрирование смеси молока с трифенилформазаном (ТФФ), образующимся при восстановлении редуктазами молока 2,3,5-трифенилтетразолия хлорида (ТФТЗХ).
Аппаратура, материалы, реактивы. Фотоэлектроколориметр лабораторный со светофильтром 520...540 нм; центрифуга с частотой вращения 1000 об./мин; баня водяная с температурой нагрева 0...100°С; пипетки градуированные вместимостью 1,5 и 10 мл; коническая стеклянная колба вместимостью 50 мл; ТФТЗХ – 0,25%-ный раствор; ацетон; ТХК – 20%-ный раствор; фосфатный буфер (рН 6,47); вода дистиллированная. Раствор ТФТЗХ готовят в склянке из темного стекла и сохраняют в холодильнике. Используемые колбы, центрифужные пробирки и пипетки должны быть стерильными.
Ход определения. В коническую колбу вместимостью 50 мл отмеривают 1 мл молока, 2,5 мл фосфатного буфера (рН 6,47) и 1 мл 0,25%-ного раствора ТФТЗХ. Смесь перемешивают и выдерживают на водяной бане при 37 °С 24 ч и затем, для осаждения белков молока, добавляют 1 мл 20%-ного раствора ТХК. После осаждения белков молока смесь центрифугируют при 1000 об./мин в течение 10 мин, и отделяют надосадочную жидкость декантацией. К осадку добавляют 10 мл ацетона, перемешивают и снова центрифугируют. Образованный трифенилформазан полностью извлекается ацетоном, а осадок становится бесцветным. Окрашенный в красный цвет раствор ТФФ колориметрируют на фотоэлектроколориметре при 520…540 нм. Специфическую активность редуктаз, по полученной оптической плотности, вычисляют по градуировочной кривой и выражают в мкг ТФФ на 1 мг белка молока за вычетом показаний контрольной пробы, где используют кипяченое молоко[1].
Таблица 73
Примечание. Анализы проводят в стеклянных стерильных пробирках вместимостью 30...40 мл и с использованием стерильных пипеток в редуктазнике (или в водяной бане в термостате) с регулируемой температурой.
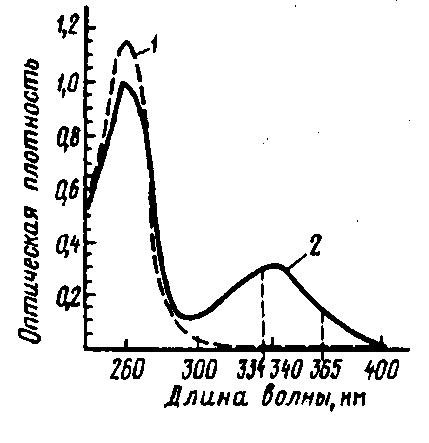
Определение активности лактатдегидрогеназы. Сущность метода. Лактатдегидрогеназа, катализируя обратимое окисление молочной кислоты, восстанавливает кофермент из НАД+-формы в НАДН-форму, которые обладают различным светопоглощением при 340 нм (рис. 53). На основе этого свойства лактатдегидрогеназы разработан автоматический инструментальный метод определения общей микробной обсемененности молока по определению содержания в нем пирувата и лактата. При определении пирувата измеряемой величиной является НАДН-форма кофермента, и его снижение содержания в молоке эквивалентно количеству в нем пирувата. При определении лактата, наоборот, образование НАДН-формы кофермента эквивалентно количеству лактата в молоке. Производительность приборов достигает 300 проб молока в день. Чувствительность метода позволяет определить примерно 20 тыс. КОЕ/мл (Suhren G., 1993).
Определение активности нитратредуктазы. Сущность метода. Восстановление нитратредуктазой молока добавленного в него нитрата до нитрита, дальнейшее связывание нитрита реактивом Грисса и визуальное фиксирование изменения окраски смеси молока с реагентами (Lück Н., 1991).
Аппаратура, материалы, реактивы. Баня водяная с температурой нагрева (37 ± 1)°С; пробирки стеклянные вместимостью 20 мл; пробки резиновые № 16; 18; пипетки вместимостью 1; 2; 10 мл; нитрат калия (или натрия) – 1%-ный раствор; сульфаниловая кислота – 0,6...0,8%-ный раствор; α-нафтиламин – 0,3...0,5%-ный раствор; уксусная кислота – 20...28%-ный раствор; вода дистиллированная. Растворы сульфаниловой кислоты и α-нафтиламина приготавливают в склянках из темного стекла. Раствор α-нафтиламина сохраняют в холодильнике не более 1 недели. Используемые пробирки, пробки и пипетки должны быть стерильными.
Рис. 53. Спектры поглощения НАД+ (I) и НАДН (2) (Heeschen W., 1978)
Ход определения. В стеклянную пробирку вместимостью 20 мл отмеривают 1 мл 1%-ного раствора нитрата калия (или натрия) и 10 мл молока. Пробирку закрывают резиновой пробкой, перемешивают, помещают в водяную баню с температурой (37 ± 1)°С и выдерживают при этой температуре в течение 4 ч. Затем в пробирку отмеривают 2 мл реактива Грисса (реактив готовят перед употреблением путем смешивания в соотношении 1:1 двух растворов: 0,6...0,8%-ный раствор сульфаниловой кислоты в 20...28%-ном растворе уксусной кислоты и 0,3...0,5%-ный раствор α-нафтиламина в том же растворе уксусной кислоты), перемешивают и через 5 мин определяют класс молока по нитратредуктазной активности в зависимости от окрашивания смеси молока с реагентами: белое – 1-й класс; от слабо-розового до ярко-розового – 2-й класс; интенсивно-розовое, красное, иногда с коричневым или желтоватым оттенком – 3-й класс.
Определение активности ксантиноксидазы. Сущность метода. Установление скорости реакции окисления добавленного к молоку ксантина или гипоксантина при использовании в качестве акцептора водорода окислительно-восстановительных индикаторов, которые при восстановлении изменяют свою окраску, или без использования индикаторов – по образованию мочевой кислоты или расходу кислорода.
Ниже приведены количественные методы определения активности ксантиноксидазы в молоке.
Определение активности ксантиноксидазы, с использованием метиленового голубого (В. В. Ковальский, Г. Г. Цой, И. Е. Воротницкая).
Аппаратура, материалы, реактивы. Трубка Тунберга (рис. 54); насос для откачивания воздуха; баня водяная с температурой нагрева (38 ± 1)°С; пипетки вместимостью 1; 2 мл и градуированные – вместимостью 1; 10 мл; ксантин – 0,1%-ный раствор или гипоксантин – 0,4%-ный раствор; 0,0113 М раствор метиленового голубого; фосфат натрия – 0,5 М буферный раствор, рН 7,2; вода дистиллированная. Растворы ксантина, гипоксантина и метиленового голубого приготавливают в склянках из темного стекла и сохраняют в холодильнике.
Ход определения. В пробирку трубки Тунберга отмеривают 5 мл молока, 0,2 мл 0,5 М буферного раствора фосфата натрия и 1 мл 0,1%-ного раствора ксантина. В шарообразную часть пробки трубки Тунберга отмеривают 0,1 мл 0,0113 М раствора метиленового голубого и закрывают пробирку пробкой. Далее из пробирки откачивают воздух (содержимое пробирки перемешивают) в течение 3 мин и добавляют метиленовый голубой к смеси молока с ксантином, перемешивают, помещают трубку в водяную баню при (38 ± 1)°С и фиксируют продолжительность обесцвечивания смеси молока с реагентами. При использовании в качестве субстрата гипоксантина в пробирку трубки Тунберга отмеривают 8,6 мл молока и 1 мл 0,4%-ного раствора гипоксантина, а в шарообразную часть пробки – 0,4 мл 0,0113 М раствора метиленового голубого и далее проводят анализ, как и с ксантином.
За единицу активности принимают количество фермента, которое в присутствии 1 мг ксантина или гипоксантина вызывает обесцвечивание 0,1 мл 0,0113 М раствора метиленового голубого в течение 1 мин при (38 ± 1)°С по сравнению с контрольной пробой, где используют кипяченое молоко.
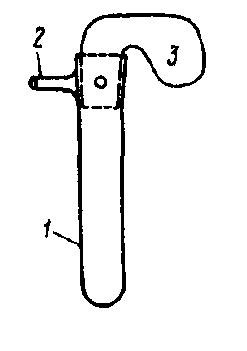
Рис. 54. Схема трубки Тунберга:
1 – пробирка со шлифом; 2 – отросток для откачивания воздуха; 3 – стеклянная пробка с шарообразным резервуаром, шлифом и отверстием для откачивания воздуха
Определение активности ксантиноксидазы с использованием ТФТЗХ (Stannard D.J., Monget D. et al.; Zittle C. A. et al.). Аппаратура, материалы, реактивы. Центрифуга лабораторная с частотой вращения 2000...3000 об/мин; фотоэлектроколориметр лабораторный со светофильтром 485 нм; баня водяная с температурой нагрева (30 ± 1)°С; пробирки стеклянные со шлифом 125x15 мм вместимостью 20 мл; пипетки градуированные вместимостью 1, 2 и 5 мл; трубки капиллярные для подачи азота; ТФТЗХ – 0,05 М раствор (334,5 мг ТФТЗХ растворяют в 20 мл 0,5 М буферного раствора (рН 7,5) фосфата натрия; уксусная кислота концентрированная; толуол; ксантин – 0,05 М раствор (растворяют 380 мг ксантина в 50 мл 0,05 н. гидроксида калия), 0,005 М раствор ксантина получают ежедневно путем разбавления 0,05 М раствора ксантина водой; вода дистиллированная; толуол; азот в баллонах. Растворы ТФТЗХ и ксантина приготавливают в склянках из темного стекла и сохраняют в холодильнике.
Ход определения. В две стеклянные пробирки вместимостью 20 мл отмеривают по 1 мл 0,5 М буферного раствора фосфата натрия (рН 7,5), 0,2 мл 0,005 М раствора ксантина и в одну из пробирок – 1,5 мл, а в другую – 1 мл воды. Затем до дна пробирок опускают небольшие капиллярные трубки, через которые в течение 5 мин подают азот с такой скоростью, чтобы можно было считать отдельные пузырьки газа. Далее в пробирку с 1,5 мл воды отмеривают 0,5 мл и в пробирку с 1 мл воды 1 мл разбавленного молока в соотношении 1:5 (цельного или обезжиренного) или сливок, разбавленных в соотношении 1:20, и продолжают подачу азота еще 5 мин. Затем в обе пробирки отмеривают по 0,2 мл 0,05 М раствора ТФТЗХ и помещают их в водяную баню с температурой (30 ± 1)°С на 10 мин, продолжая подачу азота. Реакцию останавливают путем добавления в пробирки по 5 мл концентрированной уксусной кислоты, прекращают подачу азота и удаляют из пробирок капиллярные трубки. К содержимому пробирок добавляют по 4 мл толуола, пробирки закрывают пробками, перемешивают и центрифугируют при 2000...3000 об./мин в течение 5 мин. Из окрашенного слоя толуола отбирают 2 мл и смешивают с 4 мл толуола. Полученную смесь колориметрируют на фотоэлектроколориметре при 485 нм. Единица активности соответствует количеству фермента, которое вызывает изменение величины оптической плотности, равной 0,036, в результате восстановления им ≈ 0,3 · 107 М ТФТЗХ за вычетом показаний контрольной пробы при 30 °С, где используют кипяченое молоко.
Следует отметить, что использование ТФТЗХ вместо метиленового голубого в качестве акцептора водорода более рационально, так как при этом нет необходимости в создании анаэробных условий.
Определение активности ксантиноксидазы по образованию мочевой кислоты (Cerbulis J., Farell Н. М., 1977). Аппаратура, материалы, реактивы. Спектрофотометр лабораторный со светофильтром 290 нм; центрифуга лабораторная с частотой вращения 3000 об./мин; баня водяная с температурой нагрева (25 ± 1)°С; пипетки градуированные вместимостью 1; 2 мл; стеклянные центрифужные, пробирки вместимостью 10 мл; ксантин (10 мг растворяют в 500 мл воды); фосфат натрия – 0,5 М буферный раствор (рН 7,5); ТХК – 20%-ный раствор; вода дистиллированная.
Ход определения. В одну центрифужную пробирку (рабочую) вместимостью 10 мл отмеривают 1 мл 0,5 М буферного раствора фосфата натрия, 0,2 мл молока, 1 мл раствора ксантина и 0,8 мл воды, в другую подобную пробирку (контрольная) – те же количества реагентов и молока, за исключением ксантина, вместо которого отмеривают воду (pH реакционной смеси 7,4). Содержимое пробирок перемешивают и помещают в водяную баню с температурой (25 ± 1)°С на 5 мин. Реакцию останавливают путем добавления 1 мл 20%-ного раствора ТХК (эту кислоту добавляют и в контрольную пробирку) и содержимое пробирок центрифугируют при 3000 об./мин. Супернатант подвергают спектрофотометрированию при 290 нм и по величине оптической плотности, используя градуировочную кривую, определяют количество мочевой кислоты.
Единица активности соответствует количеству фермента, катализирующего реакцию со скоростью образования 1 мкмоль мочевой кислоты в течение 1 мин (за вычетом показаний контрольной пробы) при 25 °С.
Определение активности ксантиноксидазы по расходу кислорода. Манометрический метод определения расхода кислорода при проявлении активности ксантиноксидазы в молоке широко распространен. Результаты анализа выражаются в количестве микролитров (мкл) кислорода, уменьшающемся в результате окисления ксантиноксидазой определенного количества гипоксантина 1 мл молока в течение 1 ч. Для проведения этого анализа обычно используют аппарат О. Варбурга (рис. 55) (В. Л. Кретович), или же изменение кислородного потенциала определяют при использовании других приборов, например полярографов (Zikakis J. Р., Wooters S. С., 1980). Однако указанные приборы сложны в использовании и могут быть рекомендованы лишь для научно-исследовательских целей.
Разработана методика определения активности ксантиноксидазы в молоке, основанная на использовании метода хемилюминесценции с применением люминометра. Пробоподготовка требует гомогенизации при 40 °С. Анализ проводят при 25 °С. Воспроизводимость метода составляет 6...12 %. В качестве хемилюминесцентной смеси используют: 1 ммоль/л гипоскантин (66 мкмоль); натриевая соль ЭДТК (6 мкмоль); хлористое железо (36 мкмоль); натрия перборат (0,1 ммоль); люминол (0,2 моль/л) и боратный буфер с рН 10,3 (Girotti S., Lodi S. et al., 1999).
Рис. 55. Схема манометра с сосудиком:
1 – манометрическая трубка; 2 – кран; 3 – опытный сосудик; 4 – центральный стаканчик; 5 – боковое ответвление; 6 – винт; 7 – каучуковая трубка
Определение активности цитохром с-оксидазы (оксидазная активность). Сущность метода. Восстановление цитохром с-оксидазой добавленного к молоку N,N,N',N'-тетраметил-n-фенилендиамин дигидрохлорида (ТМФАХ) и визуальном фиксировании изменения окраски смеси молока с реагентом.
Аппаратура, материалы, реактивы. Баня водяная с температурой нагрева (30 ± 2)°С; пробирки стеклянные вместимостью 20 мл; пробки резиновые № 16, 18; пипетки вместимостью 1; 10 мл; ТМФАХ – 1%-ный раствор, приготавливают в склянке из темного стекла и сохраняют в холодильнике не более 1 нед (лучше свежеприготовленный); вода дистиллированная. Используемые пробирки, пробки и пипетки должны быть стерильными.
Ход определения. В пробирку вместимостью 20 мл отмеривают 10 мл молока и 1 мл 1%-ного раствора ТМФАХ, закрывают пробкой, перемешивают путем трехкратного переворачивания и помещают в водяную баню с температурой (30 ± 2)°С на 30 мин. Если сырое молоко свежее, то смесь в пробирке приобретает фиолетовое окрашивание в течение 5...15 мин. При анализе несвежего сырого молока смесь в пробирке остается белого цвета или отмечается появление фиолетового кольца в верхней части смеси, или появляется слабофиолетовое окрашивание всей смеси в течение более 15 и до 30 мин. При анализе свежего пастеризованного молока смесь в пробирке приобретает фиолетовое окрашивание в течение 3...8 мин, а несвежего – в течение более 10 мин (Королева Н. С, Семенихина В. Ф.; Шидловская В. П. и др., 1979; Шидловская В. П., 1997). В зависимости от продолжительности восстановления 1%-ного раствора ТМФАХ сырое и пастеризованное молоко по оксидазной активности оценивают согласно данным, приведенным в табл. 75.
Для пастеризованного молока рекомендована предварительная выдержка при 20 °С в течение 18 ч с добавлением ингибитора для грамположительных бактерий.
Аппаратура, материалы, реактивы. Баня водяная с температурой нагрева 20 °С; пробирки стеклянные вместимостью 20мл; пипетки градуированные вместимостью 1 и 5 мл; ТМФАХ – 1%-ный раствор (свежеприготовленный); бензилиден хлорид – 0,03% (вес/объем); вода дистиллированная. Используемые пробирки, пробки и пипетки должны быть стерильными.
Таблица 75

Ход определения. В стеклянную пробирку вместимостью 20 мл отмеривают 4 мл пастеризованного молока, предварительно выдержанного с ингибитором при 20°С в течение 18 ч и 1 мл 1%-ного раствора ТМФАХ, перемешивают и помещают в водяную баню (с температурой 20 °С) на 10 мин. Затем визуально оценивают степень выраженности голубого окрашивания смеси молока с реагентами. Выраженность голубого окрашивания усиливается с увеличением содержания грамотрицательных психрофильных бактерий. Чувствительность метода составляет 104 КОЕ/мл. Этот метод можно использовать и для сырого молока, однако желательно предварительно составить шкалу цветности.
Следует отметить, что метод определения цитохром с-оксидазы с использованием ТМФАХ прост, быстр и недорог, но имеет следующие недостатки: использование только свежего раствора ТМФАХ; не определяется оксидазоотрицательная психрофильная микрофлора или психрофильные колиформы; реагент ТМФАХ участвует в реакции восстановления нитратов (Kroll R. G., 1993).
Для определения активности цитохромоксидаз сырого молока в качестве реагентов используют также N,N-диметил-n-фенилендиамин хлорид (ДМФАХ) с α-нафтолом (реактив НАДИ). В присутствие цитохромоксидаз оценивают степень голубого окрашивания образованного индофенола.
Аппаратура, материалы, реактивы. Баня водяная с температурой нагрева 30°С; пробирки стеклянные (стерильные) вместимостью 20 мл; пипетки (стерильные) вместимостью 1 и 10 мл; ДМФАХ – 1%-ный раствор (свежеприготовленный); α-нафтол – 1%-ный спиртовой раствор; вода дистиллированная.
Ход определения. В пробирку вместимостью 20 мл отмеривают 10 мл свежеприготовленной смеси (1:1) 1%-ных растворов ДМФАХ и α-нафтола, перемешивают и помещают в водяную баню (30 °С) на 30 мин. Затем визуально оценивают степень голубого окрашивания смеси молока с реагентами с указанием отрицательной или положительной реакции:
|
Оксидазоотрицательная |
+ |
|
Слабооксидазоположительная |
++ |
|
Отчетливооксидазоположительная |
+++ |
|
Сильнооксидазоположительная |
++++ |
Такая оценка соответствует высшему, 1-му, 2-му и 3-му классам по редуктазной пробе с использованием резазурина. Метод наиболее объективен для молока высшего и 1-го классов (Kulä-Siurda A. J., Antila V).
Имеются также специальные ОКСИ-тесты для определения цитохромоксидазной активности отдельных культур психрофильных бактерий, представляющие собой специальные бумажные полоски, предварительно обработанные растворами ДМФАХ и α-нафтола (производство Чешской республики, фирма PLIVA-Lachema). Используют также набор жидких реактивов, содержащих в определенных соотношениях растворы ДМФАХ и α-нафтола, и полоски фильтровальной бумаги. Один набор, как и набор ОКСИ-тестов, содержит 50 полосок. Набор жидких реактивов производит ООО-БиоКомпас-С, г. Углич.
Определение активности сульфгидрилоксидазы. Для определения активности этого фермента в молоке достаточно надежным и несложным является потенциометрический метод, сущность которого состоит в определении изменения потенциала (мВ) при окислении ферментом глутатиона, добавленного к молоку. Смесь для потенциометрического титрования готовят следующим образом: в стеклянный стаканчик вместимостью 150 мл отмеривают пипеткой 25 мл молока, 25 мл буферного раствора 0,1 М Трис-/NO3 (рН 7,0) и 10 мл 0,0001 М раствора глутатиона. Реакцию проводят при 37 °С и смесь титруют 0,001 М раствором нитрата серебра (Kiermeir F., Ranfft К.).
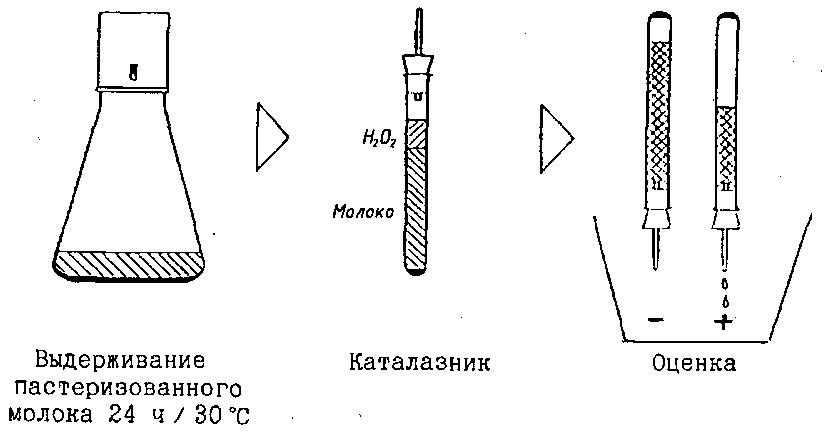
Определение общей активности каталазы (Nageswararao G., Blobel Н. et al.). Сущность метода. Определение количества кислорода, выделившегося при разложении каталазой перекиси водорода, добавленной к молоку.
Качественные методы определения активности каталазы в молоке. I. Аппаратура, материалы, реактивы. Каталазник (рис. 56); водяная баня с температурой нагрева (25 ± 1)°С; пипетки вместимостью 5, 10 мл; пробки резиновые № 14; перекись водорода – 3%-ный стерильный раствор; вода дистиллированная стерильная. Раствор перекиси водорода быстро разлагается, поэтому его следует готовить в небольших количествах и хранить в склянках из темного стекла в холодильнике. Используемые каталазник, пробирки, пробки, трубки и пипетки должны быть стерильными.
Ход определения. В каталазник отмеривают 10 мл молока при температуре 25 °С, 2 мл стерильного 3%-ного раствора перекиси водорода и 3 мл стерильной дистиллированной воды. Каталазник быстро закрывают пробкой и перемешивают его содержимое путем переворачивания. Пробку вынимают и в каталазник быстро вставляют другую резиновую пробку с вставленной в нее стеклянной градуированной стерильной трубкой с внутренним диаметром около 2...3 мм (типа градуированной пипетки вместимостью 2 мл) так, чтобы конец трубки в каталазнике был достаточно погружен в реакционную смесь. Уровень смеси в каталазнике подводят к нулевой отметке трубки, каталазник помещают в водяную баню с температурой (25 ± 1)°С и производят отсчет уровня смеси, поднявшейся в трубке, через 2 ч (можно через 30 мин). Результат выражают количеством выделившегося кислорода (в %): V1 · 100 / V2, где V1 – уровень реакционной смеси, поднявшейся в трубке, мл; V2 – объем молока, взятого для анализа, мл.
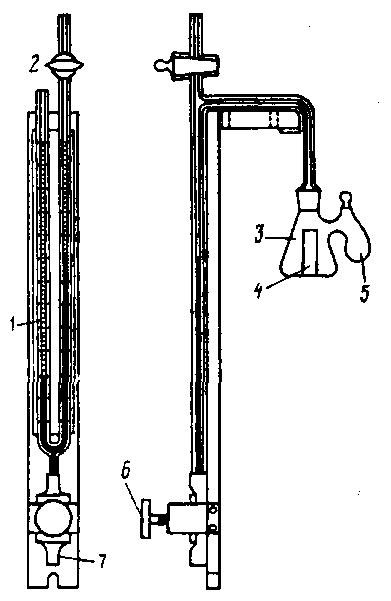
Рис. 56. Каталазник:
1 – цилиндрический сосуд; 2 – резиновая пробка № 14, 16; 3 – трубка, внутренний диаметр 2…3 мм
В зависимости от количества кислорода, выделившегося при 25 °С, общую каталазную активность молока оценивают следующим образом (см. табл. 76).
В целях выявления причин повышенной каталазной активности пастеризованного молока проводят соответствующий тест со свежепастеризованным молоком (возможная остаточная активность) и с выдержанным (остаточная активность фермента в результате вторичного бактериального обсеменения) молоком. Разница активностей указывает на степень вторичного обсеменения пастеризованного молока (рис 57).
Таблица 76

Рис. 57. Схема проведения метода по определению активности каталазы в пастеризованном молоке с предварительной выдержкой (Spillman H., Banhegui М. еt а1., 1993)
- II. Аппаратура, материалы, реактивы. Термостат с регулируемой температурой (30 ± 1)°С; каталазник с резиновой пробкой и вставленным в нее стеклянным капилляром, стерильные; колба стеклянная коническая вместимостью 250 мл с алюминиевым колпачком, стерильная; пипетки вместимостью 1, 2, 5 и 25 мл, стерильные; раствор пенициллина – Г/натриевая соль, 333 МЕ/мл, стерильный; стерильный раствор желчных солей – 6,8%-ный; перекись водорода – 3%-ный стерильный раствор. Все растворы должны храниться в холодильнике не более 1 недели.
Ход определения. В коническую колбу вместимостью 250 мл отмеривают 33 мл пастеризованного молока (сливок), 0,5 мл раствора пенициллина с активностью 333 МЕ/мл и 0,5 мл 6,8%-ного раствора желчных солей (для ингибирования грамположительных бактерий), перемешивают и выдерживают в термостате при (30 ± 1)°С в течение 1 сут. Затем в каталазник отмеривают 5 мл выдержанного молока и 1 мл 3%-ного раствора перекиси водорода. Каталазник закрывают резиновой пробкой со вставленным в нее стеклянным капилляром и опускают ее так, чтобы капилляр не касался уровня смеси. Каталазник переворачивают на 180° и быстро помещают в чашу. Вытекание смеси из капилляра в чашу наблюдают через 10 и 30 мин. Вытекание смеси из капилляра указывает на положительную реакцию. При используемом объеме молока предел обнаружения составляет 3...4 КОЕ/100 мл. При использовании молока 100 мл или 1 мл предел обнаружения бактерий составляет 1 КОЕ/мл или 100 КОЕ/100 мл соответственно. При взятии более 33 мл молока продолжительность выдерживания в термостате увеличивают для получения четкого результата.
Количественный метод определения активности каталазы в молоке. Сущность метода. Фиксирование по хронометру продолжительности всплытия бумажного диска, предварительно смоченного молоком, в результате образования кислорода при реакции каталазы молока с перекисью водорода.
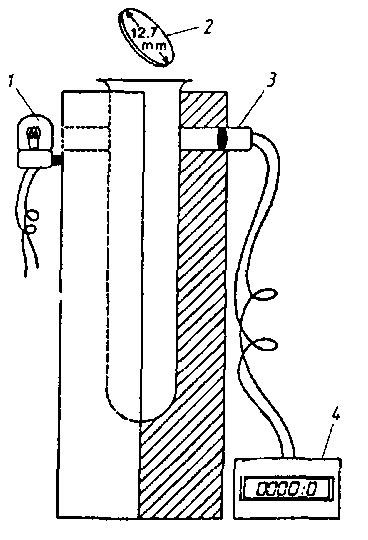
Аппаратура, материалы, реактивы. Каталазиметр (рис. 58); стеклянная пробирка ≈ 15x150 мм; бумажный диск диаметром 12,7 мм (фирма Scheicher and Schuell Co. №57 G-H); медицинский пинцет; пипетка вместимостью 5 мл; перекись водорода – 3%-ный стерильный раствор; ЭДТК – 10-6 М стерильный раствор; спирт этиловый (96...97%-ный) – 0,02%. Используемые пробирки, пипетки и пинцет должны быть стерильными
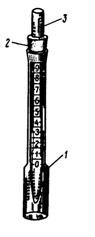
Рис. 58. Каталазиметр (по Dubois G. et а1., 1982):
1 – источник света; 2 – бумажный диск; 3 – фотоэлемент; 4 – хронометр
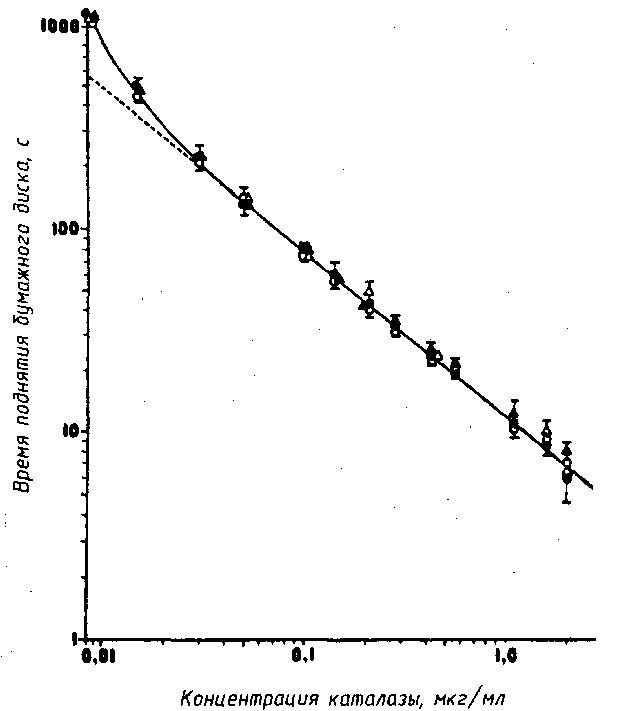
Ход определения. В помещенную в каталазиметр стеклянную пробирку ≈ 15x150 мм отмеривают 5 мл 3%-ного раствора перекиси водорода в 10-6 М растворе ЭДТК (раствор ЭДТК образует комплекс с тяжелыми металлами, которые могут служить ингибиторами каталазы). Бумажный диск помещают в анализируемое молоко, в которое предварительно добавляют 0,02 % 96...97%-ного этилового спирта (этиловый спирт препятствует возможному ингибированию каталазы), хорошо смачивают и с помощью медицинского пинцета помещают в пробирку каталазиметра. Хронометр каталазиметра измеряет продолжительность, в секундах, опускания диска на дно пробирки и поднятия его до уровня источника света и фотоэлемента. При высокой концентрации каталазы, содержащейся в молоке, продолжительность всплытия бумажного диска составляет менее 10 с, а при невысокой концентрации – до нескольких минут. Коэффициент корреляции между продолжительностью всплытия бумажного диска (в секундах) и концентрацией каталазы (в мкг/мл молока) составляет – 0,91. По градуировочной кривой (рис. 59) определяют концентрацию каталазы по времени всплытия бумажного диска. Анализ проводят при 20 °С. Предел обнаружения каталазы составляет 0,05...2,0 мкг/мл молока.
Рис. 59. Градуировочная кривая определения концентрации каталазы в зависимости от времени поднятия бумажного диска (≈ 400 измерений в том числе от 5 до 10 измерений в каждой точке)
Определение активности лактопероксидазы. Сущность метода. Использование свойств лактопероксидазы катализировать окисление различных фенолов, ароматических аминов и других соединений перекисью водорода. Наиболее распространенными из них являются: гваякол, пирогаллол, бензидин, пирокахетин и особенно n-фенилендиамин дигидрохлорид. По изменению окрашивания смеси молока, добавленных к нему раствора перекиси водорода и того или иного окисляемого вещества (визуально, фото- или спектрометрически) судят об активности фермента.
Качественный метод определения активности лактопероксидазы (ГОСТ 3623 «Молоко и молочные продукты. Методы определения пастеризации»).
- С использованием субстрата – n-фенилендиамин дигидрохлорида. Метод основан на разложении перекиси водорода лактопероксидазой, содержащейся в молоке (молочных продуктах). Освобождающийся при разложении перекиси водорода активный кислород окисляет n-фенилендиамин дигидрохлорид, образуя диамин – соединение синего цвета.
- II. С использованием субстрата – иодистокалиевого крахмала. Метод основан на разложении перекиси водорода лактопероксидазой, содержащейся в молоке (молочных продуктах). Освобождающийся при разложении перекиси водорода активный кислород окисляет йодистый калий, освобождая йод, образующий с крахмалом соединение синего цвета.
При отсутствии лактопероксидазы цвет смеси молока (молочных продуктов) с реагентами не изменяется. Следовательно, молоко (молочные продукты) подвергались пастеризации при температуре не ниже 80 °С. При наличии лактопероксидазы появляется темно-синее окрашивание. Следовательно, молоко (молочные продукты) не подвергались пастеризации, или подвергались пастеризации при температуре ниже 80 °С, или были смешаны с непастеризованным молоком (молочными продуктами.)
Чувствительность обоих методов позволяет обнаружить примесь сырого молока или пастеризованного при температуре ниже 80 °С в количестве не менее 5 %.
Количественный метод определения активности лактопероксидазы.
- С использованием субстрата – n-фенилендиамин дигидрохлорида.
Сущность метода, (см. качественный метод I).
Аппаратура, материалы, реактивы. Фотоэлеклроколориметр лабораторный со светофильтром 490 нм; колбы стеклянные вместимостью 100, 500 мл; пипетки градуированные вместимостью 1 мл; цилиндр стеклянный вместимостью 100, 250 мл; перекись водорода – 0,3 н. раствор; n-фенилендиамин дигидрохлорид – 2%-ный раствор; медь сернокислая – 2%-ный раствор; вода дистиллированная.
Ход определения. В колбу (рабочую) вместимостью 100 мл отмеривают 40 мл воды, 0,1 мл молока, 0,5 мл 2%-ного раствора n-фенилендиамин дигидрохлорида и перемешивают. Затем в ту же колбу отмеривают 0,1 мл 0,3 н. раствора перекиси водорода и снова перемешивают (температура всех реагентов 20 °С). Содержимое колбы переносят в кювету фотоэлектроколориметра с рабочей длиной 50 мм и колометрируют против холостой пробы при 490 нм. Показания оптической плотности снимают каждые 30 с в течение 2,5 мин. Холостую пробу готовят тем же путем, но вместо молока добавляют 0,1 мл воды.
Единица активности соответствует количеству фермента, которое вызывает изменение оптической плотности смеси молока с реагентами на 1 ед. при 490 нм в течение 1 мин при 20 °С. Эта единица активности соответствует определенному соотношению окисленного и неокисленного n-фенилендиамин дигидрохлорида, определяемого по градуировочной кривой.
Построение градуировочной кривой. Приготовление раствора окисленного n-фенилендиамин дигидрохлорида: 20 мг реактива помещают в колбу вместимостью 500 мл и отмеривают в нее 200 мл воды. В ту же колбу отмеривают по 1 мл 2%-ного раствора сернокислой меди и 0,3 н. раствора перекиси водорода. Приготовление раствора неокисленного n-фенилендиамин дигидрохлорида проводят аналогично, но без добавления растворов сульфата меди и перекиси водорода. Растворы окисленного и неокисленного n-фенилендиамин дигидрохлорида смешивают таким образом, чтобы их общее количество было постоянным. Оптическую плотность составленных смесей измеряют на фотоэлектроколориметре при 490 нм и строят градуировочную кривую, откладывая на оси ординат величину оптической плотности, а на оси абсцисс – логарифм соотношения первоначальной концентрации n-фенилендиамин дигидрохлорида к количеству остаточного неокисленного n-фенилендиамин дигидрохлорида.
- II. С использованием субстрата – диаммониевой соли 2,2'-азино-ди-3-этил-2,3-дигидробензотиазолин-сульфоновой кислоты (АБТС).
Аппаратура, материалы, реактивы. Спектрофотометр со светофильтром 436 нм; миксер или магнитная мешалка; секундомер; пробирки стеклянные вместимостью 10 мл; пипетки градуированные вместимостью 1, 5 мл; фосфатный буфер – 0,1 М (рН 6,4); раствор АБТС – 10 ммоль; раствор перекиси водорода – 10 ммоль; кислота уксусная – 10%-ный раствор с 1 М цитрата натрия; коммерческий препарат лактопероксидазы с известной ферментной активностью; вода дистиллированная.
Ход определения. В пробирку вместимостью 10 мл вносят 2,25 мл 0,1 М фосфатного буфера (рН 6,4), 150 · 10-3 мл 10 ммоль АБТС и 150 · 10-3 мл 10 ммоль раствора перекиси водорода.
Смесь перемешивают на магнитной мешалке или в миксере и оставляют при комнатной температуре на 15 мин. После того, как температура смеси достигнет комнатной, ее переливают в кювету спектрофотометра (толщина слоя 1 см). Реакцию инициируют добавлением в кювету 10 · 10-3 мл исследуемого образца молока и измеряют на спектрофотометре оптическую плотность опытной пробы по отношению к холостой пробе при 436 нм. Холостую пробу готовят так же, как и опытную, но вместо молока к реакционной смеси добавляют 10 · 10-3 мл дистиллированной воды. Оптическую плотность смеси измеряют с 30-секундным интервалом в течение 3-х минут. Если отсутствует автоматическая запись динамики процесса, строят кривую зависимости оптической плотности от времени реакции. Определяют изменение реакционной смеси за 1 мин (ΔD436/мин), используя начальную часть линейного участка кривой. Активность фермента рассчитывают по формуле
где А – активность фермента, выраженная в международных единицах, мкмоль/мин/мл; ΔD436 – изменение оптической плотности за 1 мин при 436 нм; Е – коэффициент экстинкции субстрата, который для АБТС при 436 нм равен 29 500 л/моль.
При расчете величины активности лактопероксидазы анализируемого образца учитывается разведение пробы.
Аисх = Аразвn,
где Аисх – ферментативная активность исходного анализируемого образца; Аразв – ферментативная активность разведенного в n раз раствора.
Для того, чтобы определить содержание лактопероксидазы в анализируемом образце, необходимо иметь чистый препарат фермента. Если в инструкции к коммерческому препарату указано, что активность лактопероксидазы определялась с использованием АБТС при тех же условиях, что и в описанном выше методе, то пересчет можно произвести с учетом данных, приведенных в инструкции (вес препарата лактопероксидазы и его активность в международных единицах). Если активность коммерческого препарата лактопероксидазы определена с использованием другого субстрата, необходимо построить градуировочную кривую, используя чистый препарат лактопероксидазы в качестве стандарта. Для построения градуировочной кривой готовят растворы лактопероксидазы на дистиллированной воде с различной концентрацией (5, 10, 15, 20, 25, 30 мкг/мл). Определение активности лактопероксидазы стандартных растворов проводят, как описано выше. Градуировочную кривую строят, откладывая на оси абсцисс концентрацию используемых стандартных растворов лактопероксидазы, а на оси ординат – соответствующие им значения А (в мкмоль/мин/мл).
При анализе цельного коровьего молока на содержание лактопероксидазы необходимо его предварительно обезжирить центрифугированием и осадить казеин добавлением смеси 10%-ной уксусной кислоты с 1 М ацетата натрия. Осадок отфильтровывают через бумажный фильтр, а в полученной сыворотке определяют активность лактопероксидазы (Тихомирова Н. А., Комолова Г. С, Ионова И. И., 2002).
При выборе того или иного метода определения активности или концентрации лактопероксидазы следует учитывать, что при использовании иодистокалиевого крахмала отмечается нелинейное соотношение между активностью или концентрацией фермента и возможностью неферментативного окисления, тогда как методы с использованием АБТС и n-фенилендиамин дигидрохлорида этого лишены.
[1] ТФФ окисляется на свету, поэтому все операции следует проводить в затененных условиях (Ильясов И. 3., Шахниев А. А.).