Тепловая обработка и гомогенизация являются основными технологическими операциями при производстве молока и молочных продуктов. Поэтому рассмотрение вопросов о влиянии этих факторов на ферментную систему сырого молока имеет важное значение.
Режимы тепловой обработки молока влияют на составные компоненты молока и взаимодействие их друг с другом. Различают следующие основные виды тепловой обработки молока: пастеризация длительная (62...65° С, выдержка 30 мин), кратковременная (74...78°С, выдержка до 18...20 с) и высокотемпературная (80...98 °С, с различной выдержкой и без выдержки); стерилизация (110...120°С с выдержкой 15...30 мин и 130...150°С – несколько секунд), в том числе УВТ-обработка (135...145°С – 2...4 с). Режимы тепловой обработки молока зависят от цели его последующего использования (Крусь Г. Н., Храмцов А. Г. и др., 2004).
Тепловая инактивация фермента является результатом денатурации его белка. Денатурация фермента – это изменение его нативной конформации, не сопровождающееся разрывом ковалентных связей. При этом наблюдаются те или иные нарушения вторичной, третичной и четвертичной структур белка (развертывание полипептидной цепи), изменения его оптических свойств, реактивности отдельных химических групп, от которых зависят каталитические свойства фермента (денатурация не влияет на аминокислотный состав фермента). Вследствие нарушения нативной конформации молекулы фермент может полностью утратить каталитическую активность. Скорость инактивации в большинстве случаев зависит от рН и быстро возрастает с повышением температуры и продолжительности ее воздействия. Ферменты молока имеют различную термостойкость, обусловленную их видом и природой происхождения. Характер и степень тепловой инактивации ферментов определяются и физическим состоянием их молекул, характером связи с теми или иными компонентами молока, что, в свою очередь, зависит от степени механического воздействия на составные компоненты молока при его получении, первичной обработке, от условий хранения и транспортирования.
Степень тепловой инактивации ферментов имеет важное практическое значение как для снижения воздействия ферментов на составные компоненты молока при его хранении, так и для достаточно объективного контроля режимов тепловой обработки молока, используемых в промышленности. Знание степени инактивации ферментов при тепловой обработке молока позволяет научно обосновать условия хранения питьевого молока (Fox Р. Е, 1995).
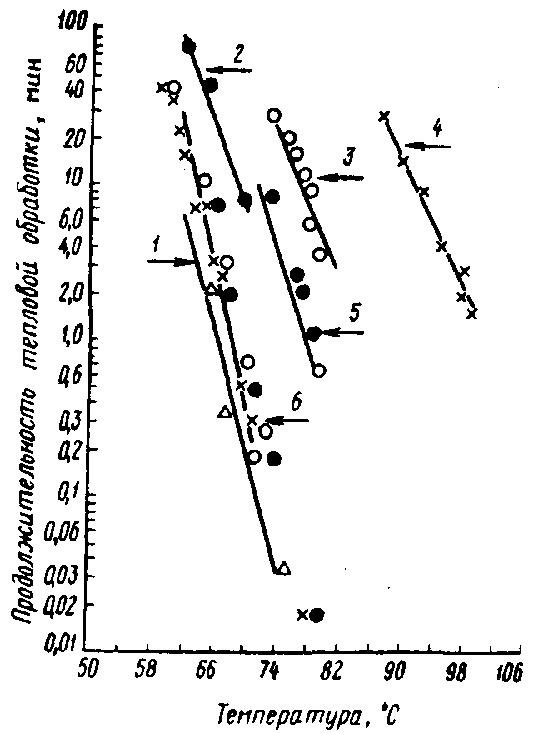
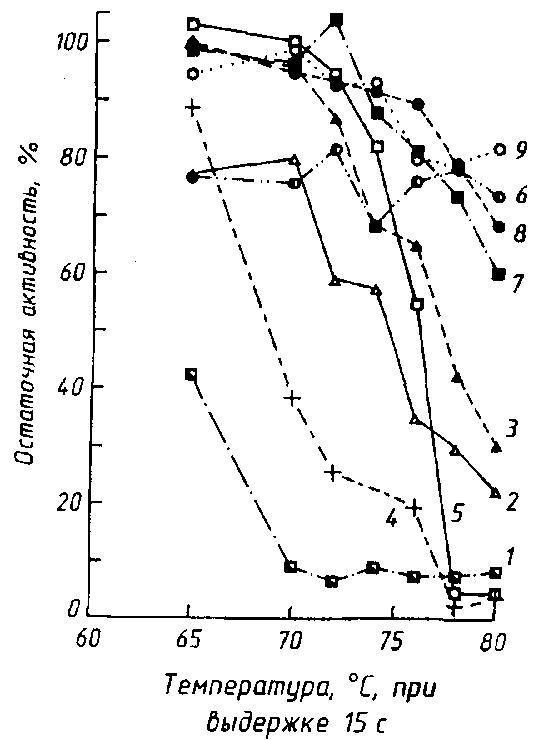
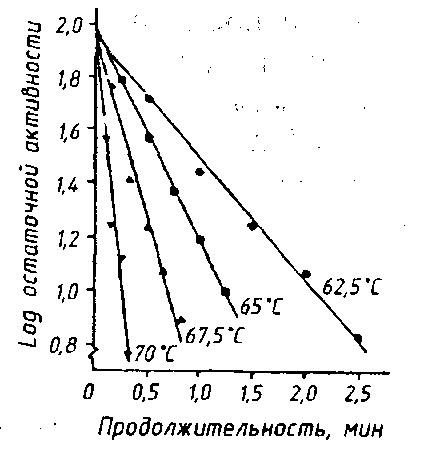
В табл. 50 и на рис. 36 и рис. 37 приведены данные по термостойкости ряда ферментов в зависимости от режимов тепловой обработки коровьего молока. Данные по тому или иному ферменту несколько различны, что объясняется неодинаковыми условиями проведения экспериментов различными авторами и, в частности, различием величин D и Z°C (Griffits М. W., 1986). Величина D – время, необходимое для 10-ти кратного изменения активности фермента при определенной температуре. Величина Z– изменение температуры, необходимое для 10-ти кратного снижения величины D.
Таблица 50
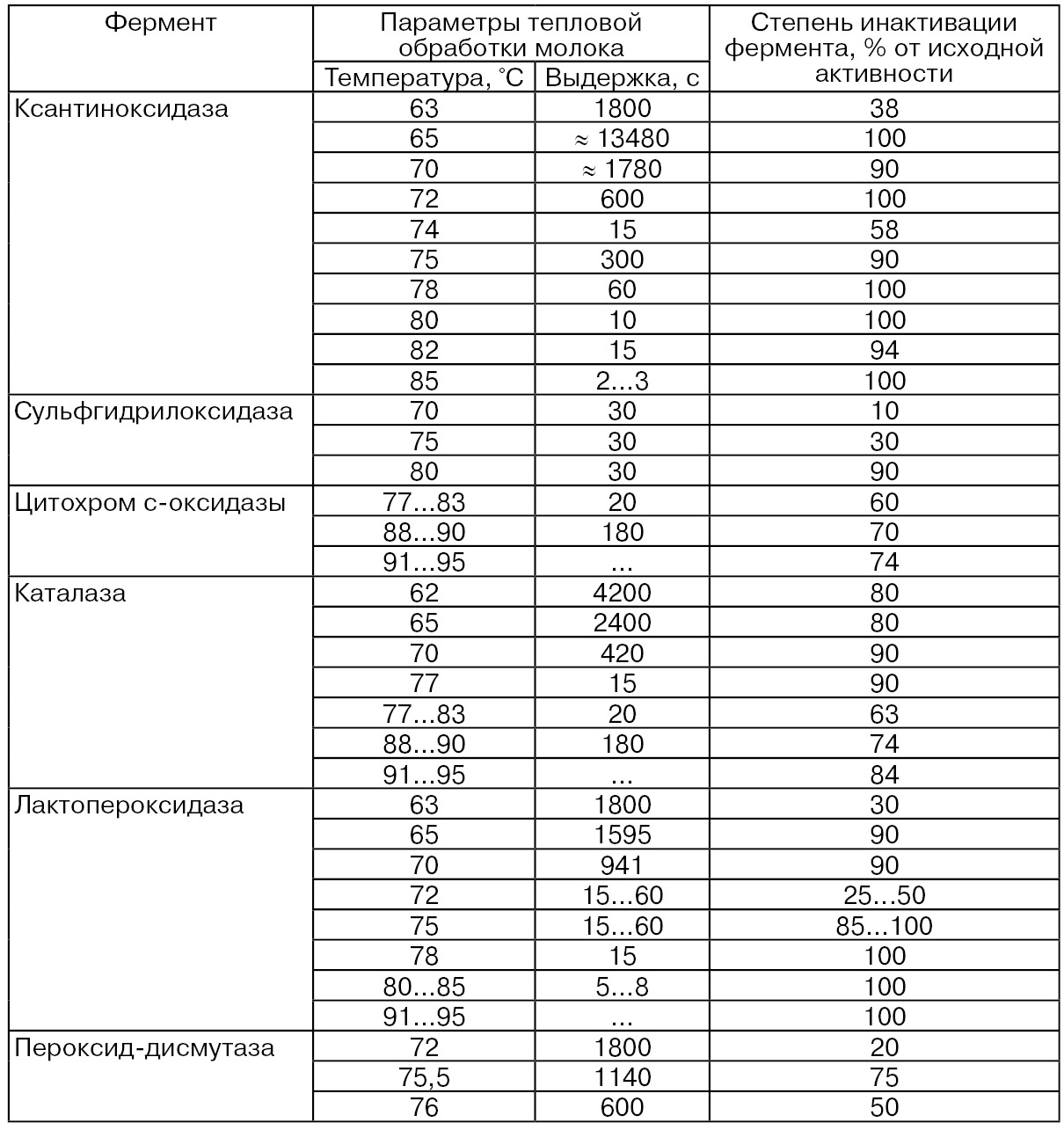
Рис. 36. Инактивация нативных ферментов в зависимости от температуры и продолжительности тепловой обработки сырого молока (полулогарифмическая зависимость) (по Linden G., 1986):
1 – липаза; 2– каталаза; 3 – лактопероксидаза; 4 – кислая фосфатаза; 5 – ксантиноксидаза; 6 – щелочная фосфатаза
Рис. 37. Влияние тепловой обработки на активность ферментов в молоке (Griffits M.W., 1986):
1 – щелочная фосфатаза; 2 – α-амилаза; 3 – β-амилаза; 4 – каталаза; 5 – лактопероксидаза; 6 – лизоцим; 7 – рибонуклеаза; 8 – ксантиноксидаза; 9 – кислая фосфатаза
Одним из наиболее изученных нативных ферментов в части его термостойкости является ксантиноксидаза. Этот фермент представляет интерес в том отношении, что при невысоких температурах тепловой обработки его активность в молоке даже повышается (Сергеев Н. С., Ананиади Л. И. и др., 1983). При 55 и 60 °С с выдержкой 5 мин активность ксантиноксидазы в молоке (перед этой обработкой оно хранилось в течение 24 ч при 5 °С) повысилась против исходного уровня соответственно на 12 и 40 %. Активность фермента даже при температуре обработки молока 70 °С с выдержкой 30 с повышалась на 42% исходного уровня. Причина этого явления заключается либо в инактивации ингибитора и повышении роли термостабильного активатора, либо в переходе неактивной формы фермента в активную (Bhavadasan M. K., Ganguli N. С, 1980). Кроме того, видимо, происходит и частичное высвобождение фермента из оболочек шариков жира. Одной из возможных причин повышения активности ксантиноксидазы при низкотемпературной тепловой обработке молока является и диссоциация молекулы фермента на субъединицы. При этом белки молока выполняют защитную роль (Наглер Л. Г., Вартанян Л. С).
По результатам многих исследований, ксантиноксидаза является довольно термостойким ферментом, остаточная активность которого при наиболее распространенном режиме пастеризации молока 72...78°С с выдержкой 15...20 с составляет 80...50%. Полная необратимая инактивация фермента происходит только при 80...85°С и выдержке 10...2 с или при 75 °С и выдержке 5 мин. Отмечают, что термостойкость ксантиноксидазы в цельном и обезжиренном молоке значительно ниже, чем в сливках (при температуре 76 °С процент инактивации составил для цельного молока ≈ 24, для обезжиренного молока ≈ 28 и сливок ≈ 2,5), что объясняют защитным влиянием жира.
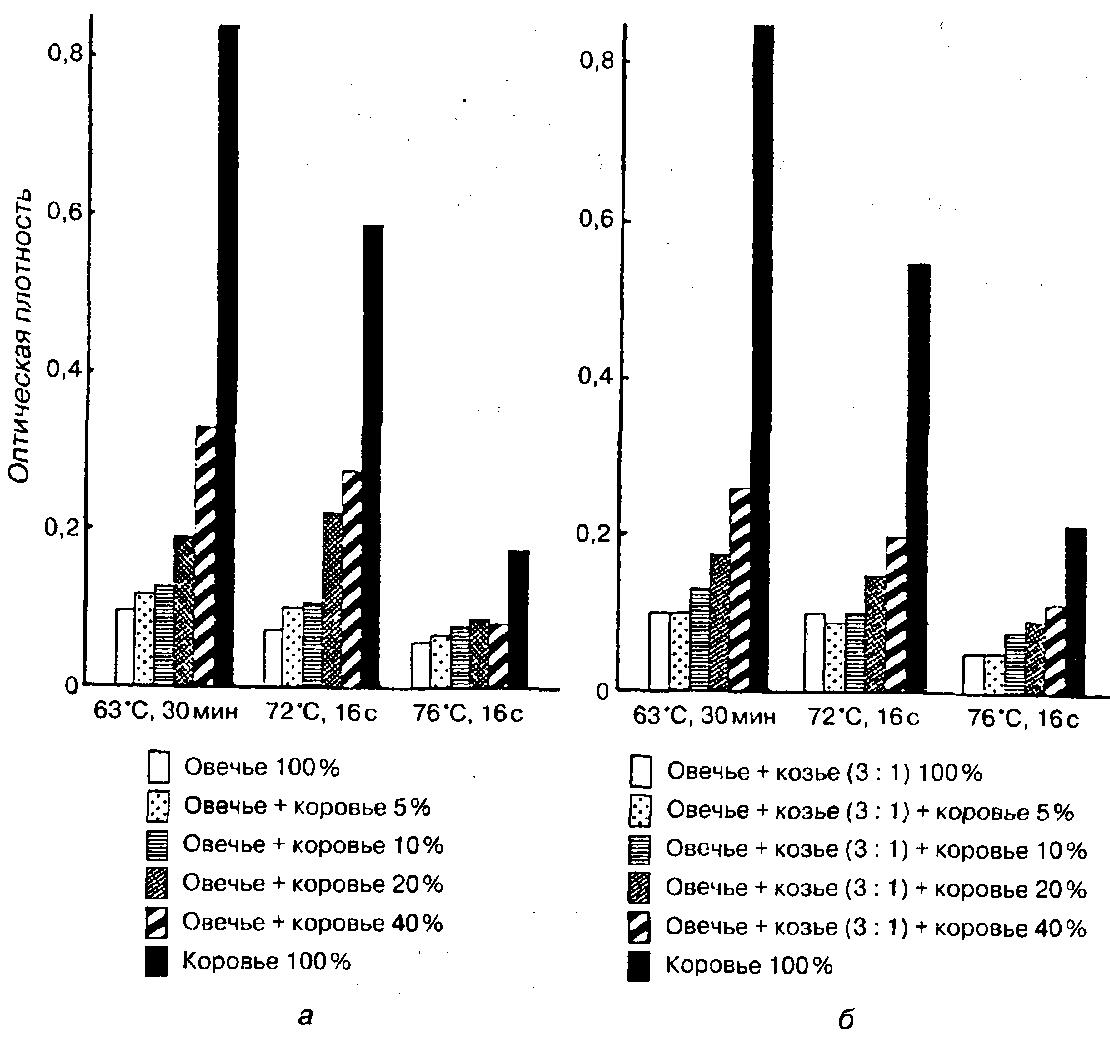
На рис. 38 показано, что снижение активности ксантиноксидазы при тепловой обработке коровьего молока в сравнении с овечьим и козьим и смесей овечьего с коровьим или козьим молоком подтверждает тот факт, что тест по обнаружению примеси коровьего молока в овечьем и козьем молоке можно использовать и для пастеризованного молока.
Несколько превышает термостойкость ксантиноксидазы термостойкость сульфгидрилоксидазы, остаточная активность которой при 75 °С и выдержке 30 с составляет 70 %. С потерей активности этого фермента связывают наличие в молоке привкуса кипяченого молока. Считают, что только при 84 °С удается определить ощутимый привкус перепастеризации кипяченого молока, когда фермент инактивирован. Поскольку сульфгидрилоксидаза достаточно сохраняет свою активность после пастеризации молока, нагретый, вареный запах и вкус (как результат образования SН-групп) при хранении молока значительно снижается. Однако при высоких температурах тепловой обработки степень выраженности вкуса и запаха перепастеризации, карамелизированных, пригорелых при хранении молока, практически, будет снижаться незначительно по причине полной инактивации фермента. В связи с этим рекомендуют при такой тепловой обработке молока использовать иммобилизованную сульфгидрилоксидазу (выделенная из молока активность фермента в 1500...3000 раз превышает активность этого фермента в молоке, например на стеклянных шариках размером 80/120 меш с контролируемыми порами диаметром 200 нм или на силикатных шариках размером 20/80 меш) (Swaisgood H.E. et al., Sliwkowski M. B., 1982).
Остаточная активность цитохром с-оксидаз при пастеризации молока, в том числе и высокотемпературной, в зависимости от ее режимов составляет 40...25 % исходной активности в сыром молоке. Таким образом, термостойкость и этих оксидаз молока достаточно высокая. Отсюда определение оксидазной активности пастеризованного молока может явиться объективным тестом контроля только высокотемпературной пастеризации молока и его стойкости в хранении.
Рис. 38. Изменение активности ксантиноксидазы при тепловой обработке коровьего молока в сравнении с овечьим и козьем молоком и их смесей (Griffits M. W., 1986)
Каталаза является менее термостойким ферментом, чем оксидазы. Однако при принятых режимах пастеризации молока ее активность может сохраниться на 15...37% от таковой в сыром молоке (Griffits М. W., 1986). При этом белки молока являются защитным фактором при тепловом воздействии на каталазу. Учитывая высокую каталитическую активность фермента, остаточная активность его совместно с каталазной активностью вторичного бакобсеменения пастеризованного молока может стать одной из причин снижения его качества в хранении (Шидловская В. П., 1982, 1997).
Лактопероксидаза относится к группе термостойких ферментов (Marks N. Е., Grandison A. S., Lewis М. J., 2001). При пастеризации молока 72...78 °С с выдержкой 15...20 с ее остаточная активность составляет 50...30 %, и только при 80...85 °С и выдержке 5...10 с или при мгновенной стерилизации трением (130...160 °С) фермент полностью инактивируется. Следует отметить, что термостойкость лактопероксидазы зависит от рН молока, так она менее термоустойчива в кислой среде (рН 5,3), что, возможно, является следствием отщепления ионов кальция от молекулы. На тепловую чувствительность лактопероксидазы оказывает влияние концентрация ионов кальция.
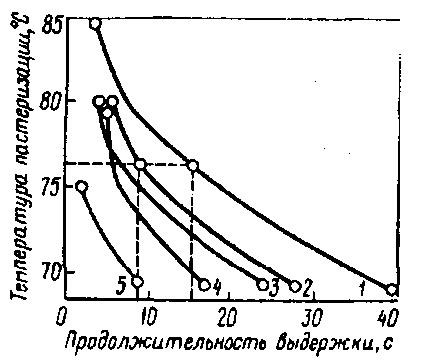
Ниже показано, что только в случае тепловой обработки молока при 74 °С в течение 10...20 мин активность лактопероксидазы не выявляется, при этом выживаемость микрофлоры молока составила 0,22 % (Kameni A. et al., Imele Н., Mbanya N. L., 2002) (табл. 51).
Таблица 51
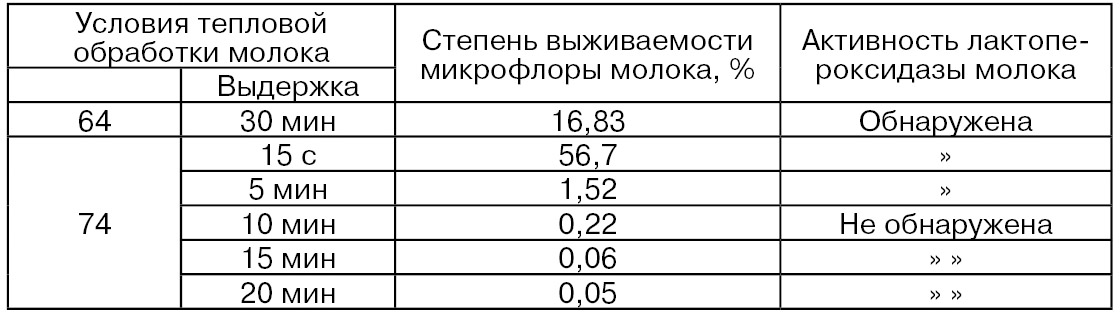
Активность лактопероксидазы служит тестом контроля высокотемпературной пастеризации молока.
Пероксид-дисмутаза характеризуется довольно высокой термостабильностью. При 72...75°С и выдержке 30...10 мин инактивируется только ≈ 30...50% фермента (Hicks С. L., 1980). При пастеризации молока – 72...78 °С с выдержкой 15...20 с пероксид-дисмутаза инактивируется незначительно. Это обстоятельство имеет большое значение, поскольку пероксид-дисмутаза предотвращает возможность окисления молочного жира, что особенно важно при хранении молока.
К термолабильным ферментам молока относятся А-фракция лактозосинтазы и карбонатдегидратаза. В то же время γ-глутамилтрансфераза относительно стабильна (по Kitchen В. J., 1985).
Важным является термостойкость гидролаз молока, катализирующих процессы гидролитического расщепления его основных компонентов. Карбоксил-, арил- и холинэстеразы относительно лабильны, в то время как ацетилхолинэстераза инактивируется при тех же температурах, что и лактопероксидаза, т. е. достаточно термостойкая. К термолабильным ферментам относятся β-галактозидаза и альдолаза.
Рис. 39. Зависимость между гибелью патогенных бактерий и инактивацией щелочной фосфатазы при различных режимах тепловой обработки молока (Королева Н. С, Семенихина В. Ф., 1980):
1 – инактивация щелочной фосфатазы; 2 – бактерии бруцеллеза; 3 – бактерии туберкулеза человека; 4 – бактерии туберкулеза животных; 5 – возбудитель тифа
Температуры, вызывающие тепловую денатурацию щелочной фосфатазы, сопоставимы с температурами, способствующими уничтожению патогенных микроорганизмов (рис. 39). Имеющийся в молоке нативный ингибитор щелочной фосфатазы является довольно термолабильным (хотя выдерживает температуру 62°С с выдержкой 30 мин), а активатор – довольно термостойким веществом. Содержание в молоке неорганического фосфата и хлорида натрия влияет на степень тепловой денатурации щелочной фосфатазы. Некоторое снижение количества неорганического фосфата по сравнению со средним его содержанием в молоке (около 20 ммоль/л,) и наличие в молоке 0,24 М хлорида натрия способствуют усилению тепловой инактивации фермента (Linden G., 1979).
Данные, приведенные в табл. 52, показывают, что при повышении параметров тепловой обработки активность щелочной фосфатазы коровьего молока снижалась быстрее, чем при тех же условиях в козьем молоке, а по абсолютным величинам всегда превышала козье молоко (Kosikowski F. V., 1988).
Таблица 52
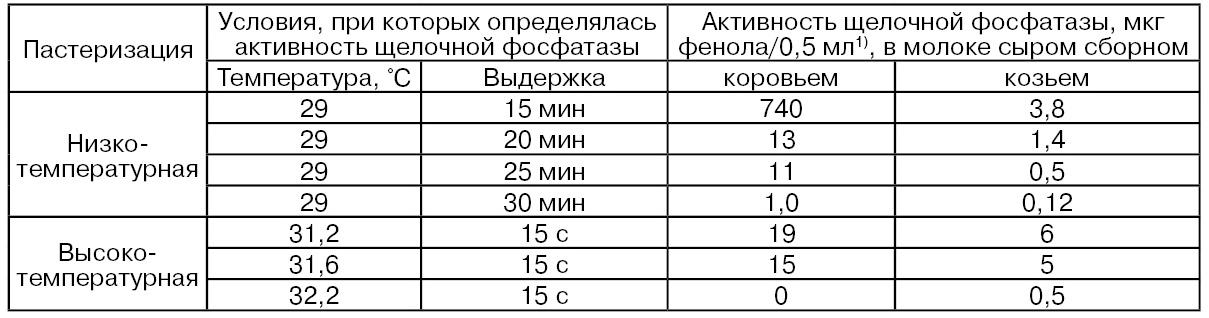
1) Величина активности щелочной фосфатазы ≤ 1 мкг фенола/0,5 мл молока указывает на достаточно эффективную пастеризацию.
Установлено, что остаточная активность щелочной фосфатазы менее чем 10 мкг n-нитрофенола/мл молока указывает на достаточную пастеризацию при ≈ 72 °С с выдержкой 15 с и при исходной активности фермента 2000...3000 мкг n-нитрофенола/мл, что соответствует примеси от 0,3 до 0,5 % сырого молока в пастеризованном молоке. Считают, что бактериальная щелочная фосфатаза более термостойкая, чем нативная. Она инактивируется только после 5-минутной выдержки молока при 70 °С. Увеличение содержания сухих веществ в молоке способствует повышению ее термостойкости (Downey W. К., 1980; Harding F., 1991). Показано, что Pseudomonas и Aspergillus продуцируют наиболее термоустойчивую щелочную фосфатазу, тогда как, например, дрожжи – значительно менее термоустойчивую.
В случае значительного обсеменения молока микрофлорой, продуцирующей щелочную фосфатазу, остаточная активность фермента может стать причиной положительной пробы на активность щелочной фосфатазы при контроле длительной и кратковременной пастеризации молока.
Таким образом, щелочная фосфатаза молока является достаточно термостойким ферментом и практически полностью инактивируется при температуре пастеризации молока 72...74°С с выдержкой 15...6 с (Schimme Е., Kiesner C. et al., 1997).
В качестве теста при контроле длительной и кратковременной пастеризации молока используют метод определения активности щелочной фосфатазы. Отрицательная реакция на щелочную фосфатазу надежно защищает потребителя от возможности распространения болезней через молоко.
Кислая фосфатаза относится к наиболее термостойким ферментам молока (при этом кислая фосфатаза, как и щелочная бактериального происхождения, имеет большую термостойкость, чем нативная, а кислая фосфатаза лейкоцитного происхождения – менее термостойкая). Если инактивация щелочной фосфатазы при длительной пастеризации молока (63 °С, 30 мин) составляет 100%, то при тех же условиях остаточная активность кислой фосфатазы равна 90...80%, а при 88...95°С 100%-ная инактивация ферментов происходит соответственно при выдержке 30 и 2 мин. Следует отметить, что значительное сохранение активности кислой фосфатазы в молоке может вызывать нежелательные изменения казеина при хранении молока, поскольку потеря кислого фосфата в результате катализирования казеина кислой фосфатазой способствует повышению его изоэлектирческой точки с рН 4,6...4,7 до 5,0...5,2, а следовательно, может привести к более ранней потери его стабильности. В связи с достаточно высокой термостойкостью кислой фосфатазы определение ее активности используют в случае контроля высокотемпературной пастеризации молока.
К достаточно термоустойчивым ферментам молока относится 5'-нуклеотидаза. Этот фермент, выделенный из ОШЖ, теряет только около 40% своей активности при тепловой обработке в течение 50...60 мин при 60°С.
Рибонуклеаза является высокотермостойким ферментом, но при этом ее активность значительно зависит от рН молока. Так, если сыворотку, полученную путем кислотного осаждения казеина (рН 4,5), в которую переходит почти вся рибонуклеаза, содержащаяся в молоке, подвергнуть тепловой обработке при 90 °С в течение 20 мин, то активность фермента в ней сохраняется. Однако при рН 7,0 и выдержке 20 мин почти вся активность фермента теряется, но при выдержке 5 мин еще оставалось 50 %. Таким образом, при любом режиме пастеризации молока остаточная активность рибонуклеазы в молоке будет достаточно высока, и поэтому сохраняется возможность снижения стабильности жировой фазы молока за счет гидролиза РНК в ОШЖ молока.
Следует отметить, что материалы по термоустойчивости рибонуклеазы несколько разноречивы. Так, по одним данным, около 40% фермента инактивировалось в обработке при 80 °С с выдержкой 15 с, а по другим, активность этого фермента незначительно снижалась даже после высокотемпературной пастеризации и УВТ-обработке. Отмечают некоторые конформационные изменения в молекуле рибонуклеазы при 63 °С и 20% потери активности при 65 °С (по Griffits M. W., 1986). Сообщается также, что рибонуклеаза полностью не инактивируется ни при кипячении в течение 30 мин, ни при 96 °С с выдержкой до 4 ч, ни при температуре 104...106°С с выдержкой 10 мин (Сайкаускене В., 1987). При стерилизации молока трением – 130...150°С (мгновенно) активность рибонуклеазы даже несколько повышается (видимо, вследствие частичной инактивации ингибитора), и только при 160 °С ее активность заметно снижается.
Ниже приведены данные по влиянию тепловой обработки молока на формы рибонуклеазы:
|
А |
Б |
II-1 |
|
|
Активность форм в сыром молоке, ед./мл[1] (%) |
5300 (72) |
2000 (27) |
63 (1) |
|
Активность форм после пастеризации, 72 °С |
2900 (70) |
1200 (29) |
56 (1) |
Наибольшей термоустойчивостью обладает фермент II-1. При этом если активность рибонуклеаз А и Б снижалась на около 45 и 40 % соответственно, а II-1 – на 1 %, то характер распределения активности этих трех форм практически не изменялся по отношению к сырому молоку (Meyer D. Н., Kunin A. S. et al., 1987).
Имеются различия в термоустойчивости амилаз молока. Некоторые исследователи отмечают снижение активности α-амилазы на 50 % при 50 °С с выдержкой 30 мин, в то время, как имеются сведения, что активность α-амилазы снижается при 74 °С с выдержкой 15 с и не полностью инактивируется при 115°С в течение 15 мин. Отмечают, что α-амилаза относительно устойчива при температуре от 70 до 80 °С в течение 15 с. При тепловой обработке молока β-амилаза более стабильна, чем α-амилаза, например при 65 °С в течение 30 мин. Менее чем 10% активности β-амилазы оставалось при 75 °С с выдержкой 30 с и полностью инактивировалась при 80 °С в течение 120 с. Величина Z (°С) для β-амилазы выше, чем для α-амилазы, что указывает на большую стабильность этого фермента (по Griffits М. W., 1986).
Как и в случае фосфатаз, белковые компоненты молока не оказывают значительного влияния на процесс инактивации амилаз. Вместе с тем повышение содержания в молоке сухих веществ способствовало повышению термостойкости α-амилазы (Daemen A. L. Н., 1981).
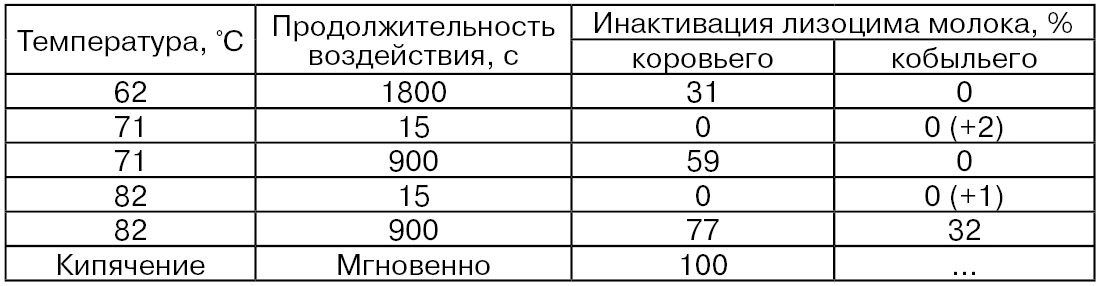
Лизоцим, как кислая фосфатаза и рибонуклеаза, относится к наиболее термостойким ферментам молока. Это очень важно, поскольку лизоцим является естественным антибактериальным компонентом молока. После пастеризации молока при 70 °С с выдержкой 30 мин активность лизоцима типа Т полностью сохранялась, а лизоцимов М и МЖ – снижалась (Мутовин В. И.). Считают, что все типы лизоцимов относительно стабильны к тепловой обработке в кислой среде (pH 3...4), но относительно лабильны при pH более 7,0, а именно 90 % активности лизоцима ингибировалось при 82 °С в течение 10 мин, а при 100 °С – в течение 2,8 мин. Отмечены некоторые конформационные изменения в молекуле фермента при температуре около 71 °С. но эти изменения не влияют на его активность (Griffits М. W., 1986; Бюл. ММФ, 1991, № 264).
Крайне термостойким является лизоцим кобыльего молока. При тепловой обработке этого молока отмечаются случаи даже некоторого повышения активности лизоцима. Такую высокую термостойкость лизоцима кобыльего молока объясняют частичным изменением структуры молекулы фермента либо инактивацией его ингибиторов.
В табл. 53 представлены сравнительные данные по термостойкости лизоцима коровьего и кобыльего молока (Chandan R., Shahani К., Kelly R.).
Таблица 53
В отношении термоустойчивости β-галактозидазы данных немного. Например, показано, что Е. coli продуцирует 2 изоформы этого фермента, при этом одна из них – основная – более стабильна к условиям тепловой обработки, чем другая форма фермента (Mahoney R. R., Wilder Т., 1987).
В части N-ацетил-β-глюкозаминидазы имеется сообщение, что ее низкомолекулярная А-форма менее термоустойчива к принятым в промышленности параметрам тепловой обработки, по сравнению с Б-формой (по Kitchen В. J., 1985).
С точки зрения предотвращения возможного развития липолиза и протеолиза в молоке, подвергнутом тепловой обработке, представляет большой интерес термостойкость липолитических и протеолитических ферментов молока (как нативного, так и микробного происхождений).
Установлено, что липопротеинлипаза обладает большей термостойкостью, чем липазы молока. При температурах пастеризации молока 68...72 °С, которые применяются в производстве сыров, значительная инактивация липопротеинлипазы происходит при выдержке от 22 до 1,5 с. В пределах температур от 35 до 50 °С происходят значительные структурные перестройки молекулы этого фермента, температура конформационного перехода составляет 51,5 °С. При разбавлении молока водой, снижении или повышении рН по сравнению с исходным молоком скорость инактивации липопротеинлипазы возрастает, что обусловлено высвобождением ее из комплекса с казеином под действием указанных факторов. Таким образом, мицеллы казеина стабилизируют липопротеинлипазу (Лебедев А. Б., Уманский М. С., 1979).
На рис. 40 показано влияние тепловой обработки на активность липопротеинлипазы в сыром обезжиренном молоке. Полная инактивация фермента отмечена при 85 °С с выдержкой 10 с.
Заметная инактивация липаз отмечается при температуре обработки молока 71...73 °С с выдержкой 15...20 с, но только при 80 °С с выдержкой 20 с липазы инактивируются полностью. Вместе с тем показано, что после пастеризации (73 °С, 15 с) молока перед УВТ-обработкой остаточная активность липолитических ферментов составила в среднем (по 20 опытам) 24,7 % (колебания от 0 до 55 %). При дальнейшей УВТ-обработке молока остаточная активность этих ферментов составляла в среднем 12,5% при прямом и 5% при косвенном способах обработки (с колебаниями соответственно от 0 до 23,6 и от 0 до 9,5 %) (Mottar T., 1981).
Рис. 40. Инактивация липопротеинлипазы при тепловой обработке сырого обезжиренного молока (Driessen F. М., 1986)
Многими исследователями подчеркивается, что бактериальные липазы молока инактивируются при более высоких температурах, чем нативные липазы (некоторые бактериальные липазы неустойчивы при 50...60°С). Данные, приведенные ниже, показывают, что выдержка, необходимая для 90%-ной инактивации этих ферментов, значительно больше, чем продолжительность выдержки (15...20 с) при кратковременной пастеризации молока (72 °С):
|
Микроорганизмы, штамм |
Выдержка, с |
|
Ps. fragi 3 |
1980 |
|
Ps. fragi 14.2 |
16,2 |
|
Ps. fluorescens 22F |
288 |
|
Ps. fluorescens 31 H |
100,2 |
|
Ps. putrefaciens R 48 |
44,4 |
|
Alcaligenes spp. 23 a2 |
96 |
|
Al. viscolactis 23 al |
34,8 |
|
Achromobacter spp. 23 О |
1980 |
|
Serratia marcescens D2 |
28,8 |
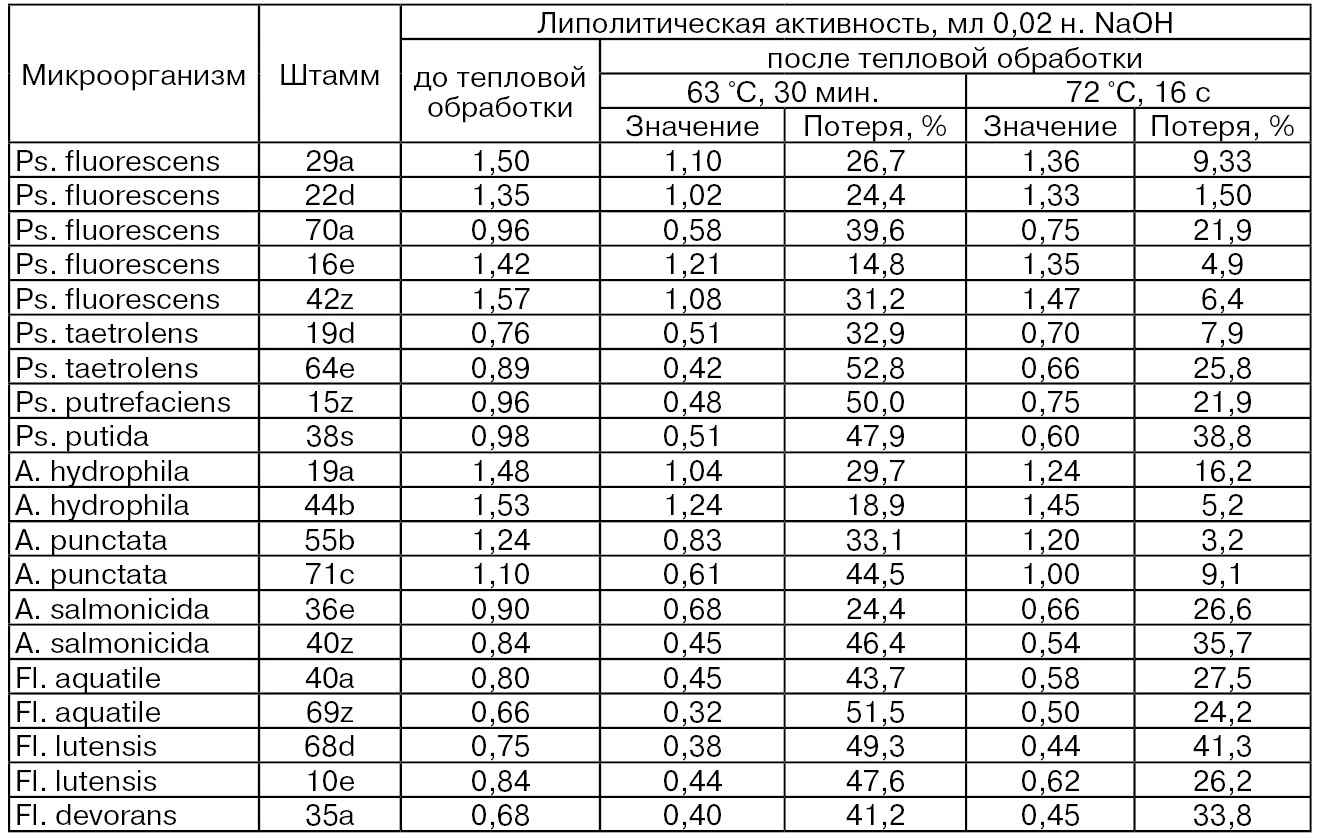
Приведенные в табл. 54 данные по влиянию тепловой обработки на активность экзоклеточных липаз 26 штаммов грамотрицательных бактерий, выделенных из сырого сборного молока, показывают, что при 63 °С в течение 30 мин или при 72 °С – 16 с снижение их активности составило в пределах 14,8...56,2 и 1,5...41,3 % соответственно. Остаточная активность липаз бактериального происхождения может явиться причиной пороков запаха и вкуса в продуктах, выработанных из молока при указанных параметрах пастеризации (Kalogridou-Vassiliadou D., 1984; Шидловская В. П., 2004).
Установлено, что инактивация экзоклеточных липаз Ps. fluorescens проходит в 2 стадии: 1) – тепловая денатурация белков при Q10 = 103,9 (число, характеризующее изменение степени реакции при изменении температура на каждые 10 °С) и 2) – химическая инактивация при Q10 = 1,9 (Renner Е., Schmidt R., 1981).
Отдельные виды Pseudomonas и Alcaligenes продуцируют липазы, обладающие довольно высокой термостойкостью, а именно отмечается сохранение их активности почти на 75 % при 90 °С и выдержке 2 мин. Отмечено, что полная инактивация бактериальных липаз молока происходит при 98 °С в течение 14...25 мин (по Моисеевой Е. Л., 1988).
Таблица 54
Нативные протеолитические ферменты молока характеризуются как довольно термостойкие. Они практически не инактивируются при обычно используемых в промышленности режимах пастеризации молока. При длительной пастеризации молока (62...65°С, выдержка 30 мин) и кратковременной (72...78 °С, выдержка 15 с) активность протеолитических ферментов незначительно снижается (например, если активности плазмина и плазминогена в сборном сыром молоке с бактериальной обсемененностью менее 50 тыс. КОЕ/мл составляла 4,0...6,0 и 20,8...26,1 ед./мл, то в пастеризованном молоке при 72 °С с выдержкой 15 с – 3,6...5,2 и 20,1...23,4 ед./мл соответственно) или даже иногда повышалась. Это повышение составляет от 8 до 30 % по отношению к первоначальной активности. Такой феномен объясняют либо модификацией белковых компонентов молока, либо частичной инактивацией ингибиторов протеолитических ферментов (Noomen А., Driessen F. М., Mottar T., 1981; Korycka-Dahl М. et al., 1983).
Отмечено, что термоустойчивости плазмина, плазминогена и ингибитора трипсина были подобны при 70 и 80 °С, при этом скорость потери их активности при 80 °С с выдержкой 10 мин была почти в 20 раз выше, чем при 70 °С в течение 1 ч (Richardson В. С, 1983).
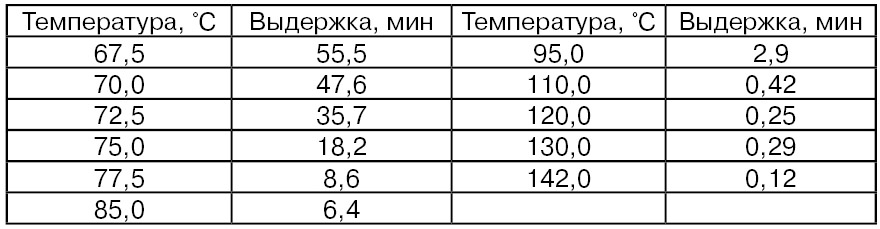
Экспериментами на обезжиренном молоке, полученном из молока в асептических условиях доения, стерильных условиях центрифугирования и подвергнутом в дальнейшем различным тепловым воздействиям, показано, что нативные протеиназы молока достаточно термостабильны и их полная инактивация наблюдалась при условиях, приведенных в табл. 55 (по Driessen F. М., 1986).
Таблица 55
Из табл. 56 видно, что остаточная активность плазмина и плазминогена почти независима от температуры (сравнение результатов для одного и того же времени нагрева), но она зависима от продолжительности выдержки. В целом плазмин достаточно устойчив к тепловой обработке, но не совсем ясно – тепловая обработка изменяет субстрат, что таким образом снижает степень гидролиза, или идет реактивация фермента после тепловой обработки. Отмечено, что величина Q10 для фермента при пастеризации составляет ≈ 3,0, а при стерилизации – ≈1,4. Термоустойчивость в значительной степени зависит от рН. Она достаточно высокая при рН 7,0 (пo Grufferty M. Е., Fox P. F., 1988).
Таблица 56
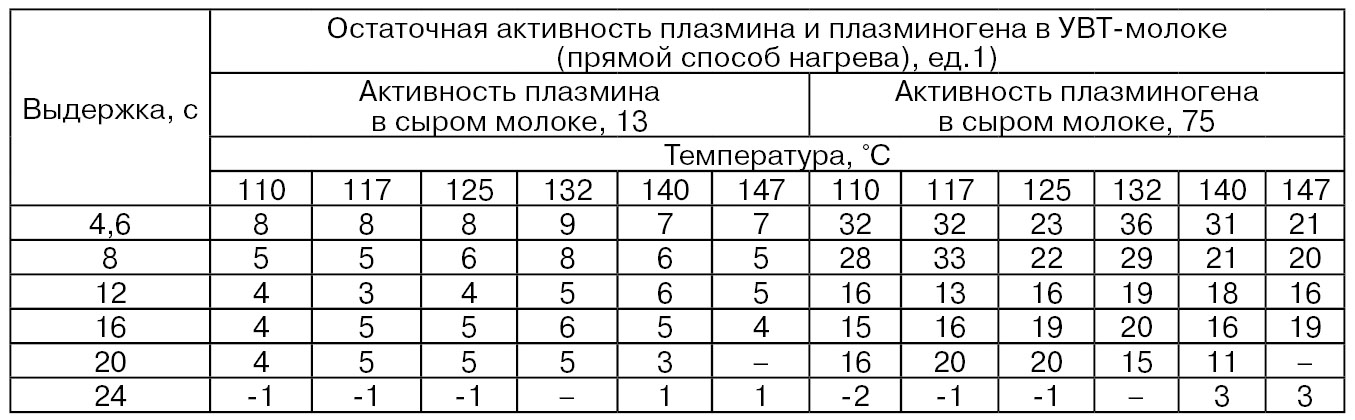
1) Для определения активности использовали спектрофотометрический метод.
Инактивация плазмина и плазминогена объясняется следующим. Тепловая обработка молока при температуре выше 70 °С вызывает денатурацию β-лактоглобулина. Денатурированный β-лактоглобулин реагирует с казеиновыми мицеллами и в том числе со связанными с ними плазмином и плазминогеном, в результате чего происходит их инактивация. Параллельно этому имеет место процесс необратимой денатурации плазмина и плазминогена, но скорость которой при 70...140 °С намного ниже, чем связывание денатурированного β-лактоглобулина с этими ферментами. В отсутствии β-лактоглобулина плазмин и плазминоген очень термоустойчивы, что может быть обусловлено высоким содержанием дисульфидных связей, которые могут служить стабилизирующим фактором по отношению к необратимой денатурации (Rollema H. S., Poli J. К., 1986).
Следует отметить, что в связи с относительно большим содержанием щелочной протеиназы – плазмина в форме плазминогена (неактивная форма) и его довольно высокой термостойкостью, а также наличием термостойкого активатора в молоке, подвергнутом тепловой обработке, при его дальнейшем хранении возникает опасность протеолиза в результате превращения неактивной формы фермента в активную (Rollema H. S., Visser S. et al., 1983; Cauvin E., Saceni P. et al., 1999).
Отмечено, что если при хранении сырого обезжиренного молока при 37 °С в течение 20 ч (при наличии консерванта) активность плазмина увеличивалась на 20 %, то его активность при хранении этого же молока, но после пастеризации (72 °С, 15 с) повысилась более, чем на 40 %, что указывает на инактивацию ингибитора активатора плазминогена (Richardson В. С, 1983).
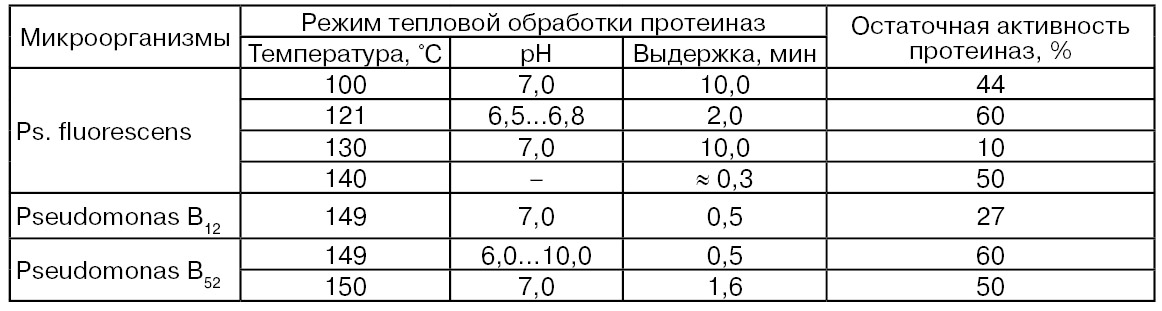
В табл. 57 дана характеристика термостойкости экзоклеточных протеиназ отдельных штаммов Pseudomonas, которые показывают, что термостойкость бактериальных протеиназ Pseudomonas очень высокая. Так, при температуре более 100 °С их остаточная активность в молоке может составить более 50 % исходной активности. Для 90 % инактивации этих ферментов Pseudomonas, при 72 °С необходима выдержка от 250 до 420 мин (Suhren G., 1981).
Таблица 57
Изучение термостойкости экзопротеаз психрофильных бактерий при 140 °С с выдержкой 5 с показало, что остаточная активность 19 штаммов Pseudomonas составила 5...45 %, Enterobacteriaceае 23 штамма – 0...50 %, Alcaligenes 12 штаммов – 5...25 %, Flavobacterium 2 штамма – 10...45 %, Acinetobacter 1 штамм – 55 %, Aeromonas 4 штамма – 0 %, и Achromobacter 1 штамм – 60 % (Griffits М. W., 1986).
Отмечено, что тепловая стабильность микробных экзопротеаз в молоке выше, чем в искусственной среде., Полагают, что при этом важна роль кальция, который защищает фермент от тепловой денатурации (Mitchell G. Е., Ewings К. N., 1986).
О сохранении активности протеолитических ферментов в молоке при различных способах УВТ-обработки свидетельствуют следующие результаты исследований: сырое обезжиренное молоко высокого бактериологического качества подвергали УВТ-обработке прямым способом (инжекция пара при 145 °С в течение 3 с с предварительной пастеризацией при 80 °С в течение 30 с) и косвенным способом (при 140 °С), хранили 5 мес и затем из мицелл казеина выделяли протеазосодержащую фракцию. Эту фракцию смешивали с молоком, которое содержало консервант, и анаэробно инкубировали в течение 6 дней при 37 °С (табл. 58). Данные табл. 58 показывают, что при УВТ-обработке молока косвенным способом инактивация протеаз была выше, чем при УВТ-обработке прямым способом. Между обсеменением сырого молока психрофильными бактериями и протеолитической активностью молока после УВТ-обработки имеется определенная зависимость, коэффициент корреляции составляет около 0,7 (Mottar J., 1981).
Таблица 58

Как и щелочная фосфатаза, нативные протеиназы молока наиболее термостойки при pH 7,0 и более лабильны при pH 5,0 и 9,0.
Таким образом, высокая термостойкость нативных и бактериальных протеолитических ферментов в условиях УВТ-обработки молока является одной из причин порчи стерилизованного молока в его длительном хранении при комнатной температуре (Garcia М. L., Sanz В. et al., 1989; Owugu R. К., Makhzoum A., Knapp J., 1991). Следовательно, в выборе тех или иных режимов стерилизации молока важным является степень инактивации в нем протеолитических ферментов.
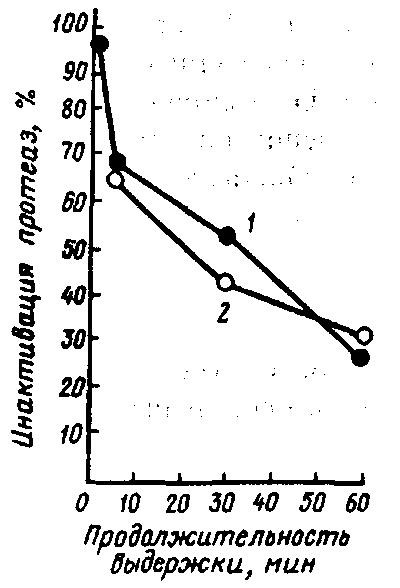
Исследованиями показано, что эффективным способом инактивации термостойких экзоклеточных протеолитических и липолитических ферментов психрофильных бактерий является низкотемпературная обработка молока. Инактивация ферментов достигается путем выдержки молока от нескольких минут до 1 ч при 50...65 °С, лучше при 55 °С. При этом такую обработку можно проводить как до, так и после УВТ-обработки молока (рис. 41).
Потенциально более чем 50 % бактериальных протеаз может быть инактивировано при температуре 55 °С в течение 60 мин, а степень липолиза после УВТ-обработки молока снижается до 40% при 60 °С в течение 5 мин (по Linden G., 1986; по Hill A. R., 1988).
Низкотемпературная инактивация протеаз психрофильных бактерий в молоке при температуре 55 °С является двухстадийным процессом. Во-первых, происходят конформационные изменения фермента, что ведет к модификации его структуры. Во-вторых, измененная молекула фермента образует комплекс фермент – мицелла казеина. При этом если конформационные изменения приводят к незначительной необратимой потере ферментативной активности, то образование комплекса обусловливает ее заметную потерю. Применение метода низкотемпературной обработки сырого молока позволяет увеличить, по крайней мере, в 2 раза срок хранения молока, стерилизованного при сверхвысоких температурах.
Рис. 41. Инактивация протеаз молока в зависимости от продолжительности выдержки при 55 °С (Barach J. Т., Adams D. М., 1978):
1 – сырое обезжиренное молоко; 2 – обезжиренное молоко после УВТ-обработки с добавлением протеаз Pseudomonas, шт. МС-60
В целом при тепловой обработке сырого молока необходимо учитывать активность тех ферментов, которые вызывают наиболее заметные изменения компонентов молока (ряд оксидоредуктаз, липазы и протеазы) в различных условиях его дальнейшего хранения и транспортирования. Чем больше активность этих ферментов, тем температура и выдержка тепловой обработки молока должны быть выше.
Считают, что устойчивость протеаз к нагреванию обусловлена наличием в структуре фермента катионов Са и Zn.
Показано, что тепловая обработка сырого молока вызывает снижение активности протеаз соматических клеток. Так, при пастеризации молока от коров, больных клиническим маститом (содержание соматических клеток составило в среднем 9,9 · 106/мл), при 63 °С в течение 30 мин остаточная активность протеаз соматических клеток составила в среднем 49,5 % (протеолитическую активность соматических клеток определяли в % гидролиза α- и β-казеина после инкубации при 37 °С в течение 24 ч) (Verdi R. J., Barbano D. M., 1988).
Имеются отдельные сведения о крайней теплолабильности альдолазы в молоке. Так, ее инактивация происходит уже при 37...45 °С в течение 30 мин. По сравнению с щелочной фосфатазой аденозиндезаминаза показывает повышенную термоустойчивость. Начиная с 35 °С с выдержкой 10 с ее активность повышалась с ≈ 300 до ≈ 750 мЕ/л и только после 75 °С отмечена инактивация фермента, а при 85 °С этот фермент был достаточно инактивирован, но с сохранением еще невысокой активности и только после высокотемпературной обработки и УВТ-обработки отмечена полная его инактивация (Martin D., Kiesner С. et al., 1998).
Реактивация (восстановление) ферментов молока. Как было показано, большинство ферментов при тепловой обработке молока необратимо изменяются, т. е. происходят денатурация их белковых молекул, химические изменения и, следовательно, потеря активности. Однако при определенных условиях наблюдается частичная реактивация инактивированного фермента. Этот процесс характерен как для относительно термостойких, так и для высокотермостойких ферментов (см. п. 3.1). Так, некоторая реактивация обнаруживается у ксантиноксидазы. Например, после нагревания сырого молока до 90,5 °С с выдержкой 15 с, последующим его сгущением до 50% и гомогенизации при 31,5 мПа, отмечается некоторое восстановление активности этого фермента при хранении полученного сгущенного молока (по Давидову Р. Б.). Явная способность к реактивации обнаружена у лактопероксидазы, щелочной фосфатазы, липаз и протеаз.
Реактивация лактопероксидазы. В связи с использованием теста на лактопероксидазу в целях контроля высокотемпературной пастеризации молока способность к реактивации этого фермента представляет практический интерес. Следует отметить, что способность к реактивации лактопероксидазы молока проявляется особенно в период перевода коров со стойлового содержания на пастбищное.
Установлено, что чем выше температура хранения пастеризованного молока, тем интенсивнее идет процесс восстановления активности этого фермента. При температурах хранения 2, 20 и 37 °С реактивируется от первоначальной активности лактопероксидазы сырого молока соответственно 0, 2,1 и 3,2 %. Различие между реактивированной и нативной лактопероксидазами установить очень трудно. Имеются данные, что реактивированная лактопероксидаза характеризуется менее высокой термостойкостью, чем нативная лактопероксидаза, так она инактивируется при последующем нагревании молока до 80 °С. При температурах тепловой обработки выше 88 °С восстановление лактопероксидазы не наблюдается, т. е. происходит необратимая инактивация этого фермента, хотя есть сведения, что этот фермент реактивирует после обработки молока при 125 °С с выдержкой несколько секунд после 1 сут хранения при 20 °С.
Реактивация щелочной фосфатазы. С точки зрения использования теста определения активности щелочной фосфатазы для контроля наиболее принятых режимов пастеризации молока (72...78°С, выдержка 15...20 с) представляет интерес рассмотреть способность этого фермента к реактивации. Имеются многочисленные исследования, свидетельствующие о такой способности щелочной фосфатазы. Установлено, что реактивация происходит в основном в молоке, подвергнутом УВТ-обработке, и реже в молоке после кратковременной и высокотемпературной пастеризации.
На процесс реактивации щелочной фосфатазы влияют различные факторы: режимы хранения сырого молока, пастеризации, гомогенизации и хранения пастеризованного молока; величина рН, исходная активность фермента, содержание жира, белка, неорганического фосфата и концентрация двухвалентных ионов некоторых металлов в молоке. Реактивация фермента ускоряется при длительном хранении молока перед пастеризацией и заметно снижается при мгновенном охлаждении молока (и сливок) после пастеризации и хранения при низких температурах. Степень реактивации щелочной фосфатазы увеличивается с повышением температуры тепловой обработки молока (73...121 °С) и уменьшается при выдержке (3...1,75 мин). Даже при стерилизации молока трением (130...160 °С, мгновенно), когда отмечается 100%-ная инактивация фермента, при последующем хранении молока наблюдается некоторая его реактивация. Максимальная реактивация фермента отмечается после тепловой обработки молока при 104,4...121,4°С и выдержке (0,57 ±0,04) с или при 102...106 °С с выдержкой (1,6 ±0,07) с. Это объясняется тем, что при такой обработке образуются определенные продукты восстановления, например тиоловые группы, которые играют существенную роль в реактивации фермента. Заметная реактивация фермента имела место, когда свежее сырое молоко нагревали до 25...40°С, затем гомогенизировали при 13,7 МПа, далее нагревали до 104,4°С с выдержкой (1,6±0,07) с, охлаждали до 4 °С и хранили при этой температуре в течение ночи. Максимальная реактивация фермента, как указано ниже, отмечалась в хранении молока при 34...35 °C (по Harding F., 1991).
|
Температура, °С, выдержка 1 ч |
25 |
28 |
30 |
32 |
34 |
35 |
37 |
40 |
|
Максимальная скорость |
0,8 |
≈ 1,3 |
≈ 1,7 |
≈ 1,9 |
≈ 2,3 |
≈ 2,6 |
≈ 1,9 |
≈ 1,2 |
Имеются данные о 60% реактивации щелочной фосфатазы при хранении молока (после высокотемпературной обработки) в течение 3 сут при 17°С (Griffits М. W., 1986). В хранении молока при 4...10 °С реактивация фермента наблюдается лишь через несколько часов.
Эксперименты с очищенными препаратами щелочной фосфатазы показывают, что оптимум рН для максимальной реактивации фермента находится в пределах от 6,2 до 6,8. Например, в молоке, нагретом до 104,4°С, максимальная реактивация имеет место при рН 6,4...6,5. Степень реактивации щелочной фосфатазы прямо пропорциональна величине активности фермента в молоке до его тепловой обработки (Murthy G. К., Сох S., Kaylor L.).
Реактивированная щелочная фосфатаза, в отличие от остаточной щелочной фосфатазы, имеет свойство в 8...10 раз повышать свою активность при добавлении к молоку ионов магния и дальнейшей инкубации его при 37°С в течение 1 ч (Серебренникова В. А., Патратий А. П., Рашкина Н. А., 1978). Реактивация щелочной фосфатазы зависит и от содержания кислорода в свободном пространстве упаковки с молоком. Этот процесс менее выражен в случае высокого содержания кислорода, что объясняется окислением SH-групп, необходимых для реактивации фермента (Linden G., 1986; Бюл. ММФ, 1986, № 200).
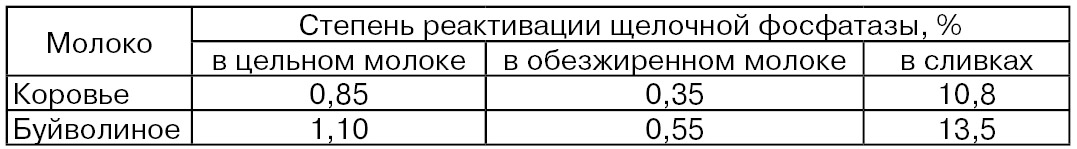
Восстановление активности щелочной фосфатазы зависит от содержания жира в молоке и молочных продуктах. Чем больше содержание жира в молоке, тем степень реактивации фермента выше (табл. 59). Эксперименты проводили с буйволиным и коровьим цельным молоком, а также с обезжиренным молоком и сливками, полученными из этих видов молока, нагретыми до 90 °С, затем охлажденными до 34 °С и хранившимися при этой температуре 10...12 ч (Sharma R. S., Ganguli N. S.).
С практической стороны представляет интерес то, что величина содержания жира в молоке и молочных продуктах влияет не только на степень реактивации фермента, но, наряду с режимами теплового воздействия, и на продолжительность периода от момента пастеризации до появления восстановленной активности этого фермента (при 31 °С), что видно из следующих данных: обезжиренное молоко (90 °С, 16 с) через 18 ч; цельное молоко (90,5 °С, 16 с) через 6 ч; сливки, жир 20% (74°С, 16 с) через 2 ч; сливки, жир 38% (82°С, 16 с) через 2ч.
Таблица 59
Отдельные белковые компоненты молока оказывают различное влияние на реактивацию щелочной фосфатазы, α- и β-казеин и β-лактоглобулин в отдельности практически не влияли на реактивацию фермента, в то время как комбинация казеина с β-лактоглобулином позволяла получить реактивацию щелочной фосфатазы, значительно большую.
На реактивацию щелочной фосфатазы определенным образом влияют ионы магния и цинка. По мере увеличения содержания в молоке ионов магния с 0,0045 М до 0,064 М количество реактивированной фосфатазы увеличивалось от 0,3 до 5,5 % (при 120-минутной выдержке молока при 34 °С, которое предварительно гомогенизировали при 34...35°С и давлении 13,7 МПа, затем подвергали тепловой обработке при 104,4°С с выдержкой (1,6 ± 0,07) с и хранили в течение ночи при 4°С). При концентрации ионов магния более 0,064 М степень реактивации снижалась (Murthy G. К., Сох S., Kaylor L.). В случае добавления ионов магния и цинка к молоку, подвергнутому тепловой обработке при 90 °С в течение 80 с и выдержанному затем в течение 8 ч при 37 °С, максимальная реактивация отмечалась при концентрации ионов магния 0,09 М и цинка 0,3 мМ. Добавление в такое молоко β-глицерофосфата (субстрата фермента) в концентрации 2 ммоль повышало степень реактивации фермента почти в 20 раз по сравнению с исходном молоком и в 9 раз – после его тепловой обработки (Linden G., 1986).
Считают, что, как и ионы магния, ионы кальция являются необходимыми компонентами процесса реактивации щелочной фосфатазы, ионы кобальта, меди и никеля снижают возможность возникновения этого процесса. Отмечают, что реактивирует только β-изоформа щелочной фосфатазы.
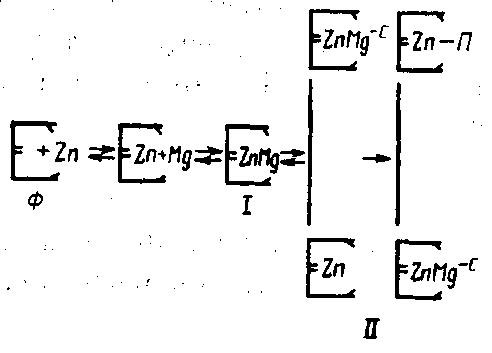
Имеется несколько теорий, объясняющих механизм реактивации щелочной фосфатазы. Одна из теорий сводится к тому, что при хранении молока ионы магния, взаимодействуя путем образования солевых мостиков с апоферментом, «возвращают» ему активность (рис. 42), Существенную роль при этом играет наличие необходимого для фермента субстрата и неорганического фосфата, которые участвуют в реассоциации и стабилизации субъединиц фермента.
Рис. 42. Стадии реактивации щелочной фосфатазы в молоке (Linden G., 1979):
Ф – фермент; С – субстрат; П – продукт; I – функциональная субъединица; II – активный фермент
Другая теория связывает реактивацию щелочной фосфатазы с инактивацией при тепловой обработке молока термолабильного ингибитора и с действием при хранении молока довольно термостабильного активатора. Возможную реактивацию этого фермента объясняют и происшедшими при тепловой обработке молока некоторыми структурными изменениями в ОШЖ, с которой связаны изоформы щелочной фосфатазы. И, наконец, существует теория, которая объясняет реактивацию щелочной фосфатазы образованием при тепловой обработке молока комплексов казеина с этим ферментом. Дело в том, что при нагревании молока часть щелочной фосфатазы, вероятно, инактивируется не термически, а путем связывания с белками молока. При дальнейшем хранении этот комплекс под действием остаточных протеаз или иных причин распадается, освобождая фосфатазу, что и объясняет ее реактивирование. Эта же теория служит одним из объяснений возможной реактивации лактопероксидазы после тепловой обработки молока. Для снижения возможной реактивации щелочной фосфатазы рекомендуются невысокие температуры пастеризации, но с продолжительной выдержкой (Linden G., 1986).
Реактивация липаз и протеаз. Реактивация липолитических ферментов отмечается в молоке высокотемпературной и кратковременной пастеризации после его хранения при низких температурах. Так, после тепловой обработки молока при температуре около 90 °С с выдержкой 3 с активность липазы несколько восстанавливается в процессе хранения молока при 4...5 °С в течение 48 ч.
Способностью к восстановлению активности обладают и протеолитические ферменты молока как нативного, так и микробного происхождений. Как было показано, для снижения активности термостойких протеолитических ферментов в молоке, предложен метод его низкотемпературной обработки (55 °С, выдержка до 1 ч). Однако после такой обработки активность инактивированных ферментов может быть частично восстановлена. Восстановление активности протеолитических ферментов отмечено и при таких жестких режимах, как стерилизация молока трением (130...160 °С, мгновенно) (Ged J., Alais Ch.).
Таким образом, возможность реактивации активности ряда ферментов молока реальна, и ее следует учитывать при контроле молока, подвергнутого тепловой обработке, в процессе хранения.
[1] 1 ед. активности – см. текст сноски на с. 77; % – от общей активности.
[2] 1 ед. соответствует количеству микрограммов фенола, образовавшегося в течение 60 мин при 40°С.