В процессе гомогенизации молоко подвергается самым сильным механическим воздействиям. Возникающие при гомогенизации силы разрушают оболочку шарика жира, в результате чего происходит его дробление на более мелкие (диаметр ≈ 1 мкм), а также могут меняться форма и структура преимущественно крупных мицелл казеина, которые приобретают неровные края, их поверхность несколько разрыхляется, происходит их диспергирование наряду с агрегированием. Вокруг вновь образующихся шариков жира возникает новая оболочка, в формировании которой участвуют в основном казеин, фосфолипиды и сывороточные белки. Поэтому при гомогенизации молока происходит определенное перераспределение ферментов, связанных с ОШЖ и с мицеллами казеина, и, соответственно, изменение их активности, которое зависит от времени проведения гомогенизации (до или после пастеризации), температуры, давления, числа ступеней и способа гомогенизации молока. Оптимальными режимами гомогенизации являются 10...20 МПа при температуре 60...65 °С, в зависимости от вида и состава изготовляемого продукта.
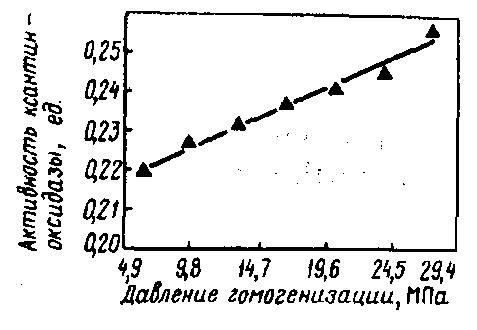
Рис. 43. Влияние давления гомогенизации на активность ксантиноксидазы сырого молока (молоко предварительно нагрето до 48 °С с выдержкой 5 мин) (Demott B. J., Praepanitchai O.A., 1978). (1 ед. соответствует количеству мкмолей мочевой кислоты, образующейся в течение 1 мин при 25 °С)
Установлено, что в результате гомогенизации молока изменяется активность ксантиноксидазы. Так, при повышении давления гомогенизации (в одну ступень) от ≈ 5,0 до 28,0 МПа при 48 °С активность этого фермента увеличивалась (рис 43). Коэффициент корреляции при этом составил 0,996.
Показано, что при гомогенизации (двухступенчатая с общей величиной давления 25 МПа при 50...60°С) сырого цельного молока с использованием в качестве субстратов для ксантиноксидазы молока 10 мг NO-3/л молока и 0,1 ммоль ксантина, ксантиноксидазная активность молока повышалась в 2,0...2,6 раза, а нитрат- и нитритдегидрогеназные активности этого фермента – в 2...3 раза. Добавление аскорбиновой кислоты в количестве 0,01 % способствовало повышению ксантиноксидазной активности почти в 10 раз, а нитрат- и нитритдегидрогеназных активностей почти в 1,5 раза. Таким образом нитрат- и нитритдегидрогеназные активности ксантиноксидазы молока являются некоторым потенциальным источником снижения содержания в молоке нитратов и нитритов (Шидловская В. П., Смотракова Н. И., 1986; Шидловская В. П., Ананиади Л. И., Львов Н. П., 1990). Повышение активности фермента объясняется его высвобождением при разрушении ОШЖ и расщеплением молекулы фермента на субъединицы. Это подтверждается тем фактом, что после гомогенизации 70 % активности ксантиноксидазы обнаруживается в водной фазе молока. При сверхвысоких (400...600 МПа) давлениях гомогенизации молока наблюдается инактивация этого фермента, видимо, в результате сильного физического воздействия на его молекулу, о чем свидетельствуют нижеприведенные данные (Olsen К., Kristensen D. et al., 2004):
|
Величина воздействия |
Снижение активности |
|
400 (120) |
17 |
|
500 (60) |
46 |
|
600 (12) |
83 |
Показано, что при двуступенчатой гомогенизации рекомбинированного молока при давлении 11,9...18,2 МПа (первая ступень) и 3,5...6,3 МПа (вторая ступень) активность ксантиноксидазы по сравнению с активностью фермента в негомогенизированном рекомбинированном молоке повышалась в 3...10 раз. Вместе с тем гомогенизация молока вызывает некоторое снижение термостойкости ксантиноксидазы (табл. 60), что, по-видимому, связано с большей подверженностью фермента тепловым воздействиям в результате высвобождения его из ОШЖ (Cerbulis J., Farrell H.M., 1977).
Таблица 60
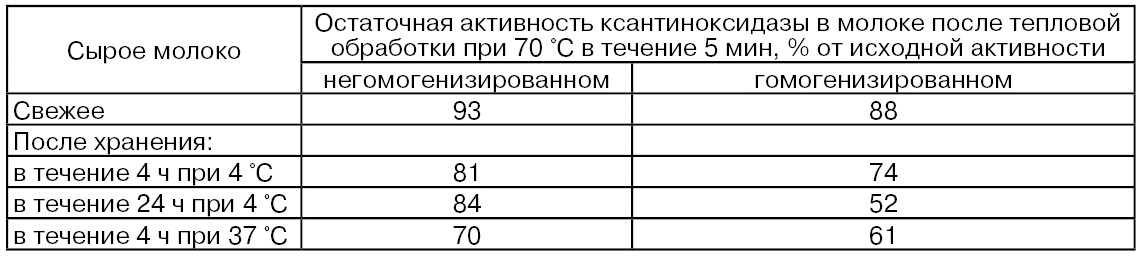
Ксантиноксидаза, десорбированная из ОШЖ молока при его механической обработке, в том числе при гомогенизации, может находиться в водной его фазе в свободной форме, связанной с нерастворимыми компонентами оболочек шариков жира или связанной с растворимыми липопротеиновыми фракциями. Количественное соотношение этих форм связи будет определять общую активность фермента в молоке.
Имеются данные о том, что активность лактопероксидазы при высоком давлении гомогенизации молока несколько снижается. Так, если при давлении 19,6 МПа и температуре 50 °С активность фермента не изменяется, то при 39,2 МПа она снижается на 25% исходного уровня в молоке. Поскольку лактопероксидаза не связана с ОШЖ или мицеллами казеина молока, высокое давление гомогенизации, видимо, оказывает сильное физическое воздействие на саму молекулу фермента, результатом чего является потеря ею активности.
На активность пероксид-дисмутазы гомогенизация влияет незначительно. Однако появляющиеся в молоке компоненты ОШЖ в результате их разрушения при гомогенизации, обладают способностью связывать пероксид-анионы (Hicks С, 1980). Таким образом, гомогенизация молока и одновременное действие пероксид-дисмутазы способствуют снижению возможных окислительных процессов в молоке путем воздействия пероксид-анионов.
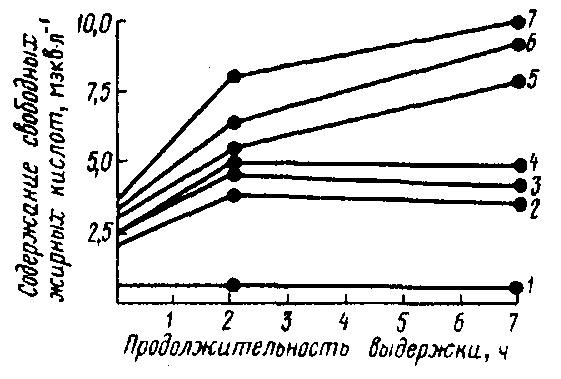
Поскольку липаза и липопротеинлипаза в основном связаны с мицеллами казеина, то гомогенизация, вызывая их частичный распад на субмицеллы, способствует высвобождению части этих ферментов, а следовательно, и сближению их с субстратом – молочным жиром. Здесь играет роль еще и тот фактор, что новые белково-липидные оболочки мелких шариков жира, имея менее прочную структуру, более проницаемы для липаз. Так, установлено, что повышение давления гомогенизации молока с 1,75 до 14,0 МПа и дальнейшее хранение такого молока в течение 7 ч при 30 °С сопровождается соответствующим повышением количества СЖК в течение первых двух часов хранения. Затем скорость липолиза выравнивается при низких величинах давления гомогенизации – от 1,75 до 3,50 МПа, в то время как при 7,0...14,0 МПа липолиз молока заметно продолжается (рис. 45). При повторной гомогенизации молока образуется новый комплекс фермента с субстратом, что обусловливает возобновление липолиза. Наиболее опасны для развития липолиза температуры гомогенизации молока от 30 до 45 °С; при температуре 20 и 63 °С степень липолиза в гомогенизированном молоке значительно снижается.
Рис. 45. Образование СЖК в сыром молоке в зависимости от давления гомогенизации и продолжительности выдержки молока при 30°С (Downey W. К., 1980):
1 – 0 МПа; 2 – 1,75 МПа; 3 – 2,10 МПа; 4 - 3,5 МПа; 5 - 7,0 МПа; 6 – 10,5 МПа; 7 – 14,0 МПа
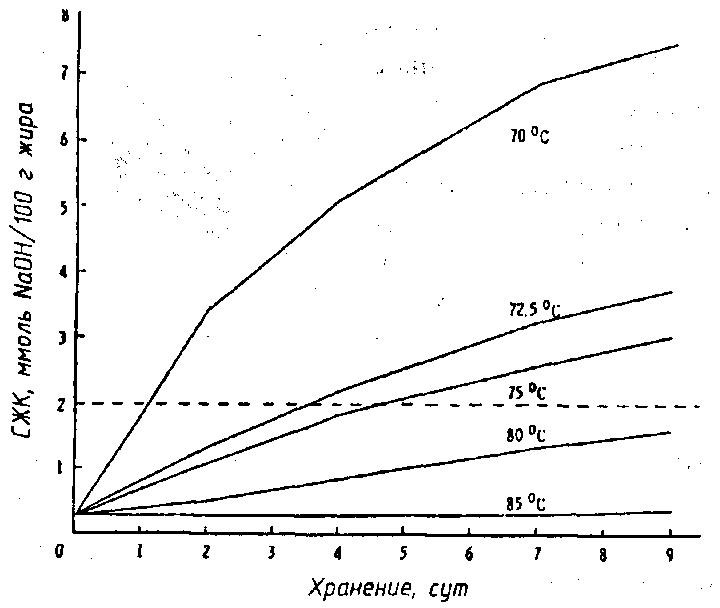
На рис. 46 показано, что в хранении при 7 °С цельного молока, гомогенизированного и пастеризованного при различных температурах, но с одинаковой выдержкой 10 с, активность липопротеинлипазы повышалась в обратной зависимости от температуры пастеризации. При температуре 70...75°С количество СЖК превышало предел возникновения в молоке горького вкуса.
Гомогенизация при давлении 10,7...21,5 МПа при 55 °С сборного цельного молока, полученного в асептических условиях, которое хранили при 4...6°С в течение 7 сут и затем пастеризовали при 72,2...78,9 °С с одинаковой выдержкой 16 с, не влияла на термическую инактивацию липаз молока (величины АДУ, практически, не изменялись и оставляли от 1,6..1,7 до 0,9 соответственно) (Shipe W.F., Senyk G. F., 1981).
Рис. 46. Изменение содержания СЖК при хранении цельного гомогенизированного молока пастеризованного при различных температурах с выдержкой 10 с, пунктиром отмечена величина предела появления в молоке горечи (по Driessen F. М., 1986)
При гомогенизации молока следует ожидать и повышение активности щелочной фосфатазы, поскольку около 50% этого фермента связано с ОШЖ. Однако результаты исследований показывают, что в негомогенизированном и гомогенизированном молоке при давлении 13,8...24,1 МПа и температуре 34...35 °С различие в величинах активности фермента было небольшим – (2750±60) ед.[2]/мл. Некоторое снижение активности фермента можно объяснить частичным физическим воздействием гомогенизации как механического фактора на молекулу фермента. Вместе с тем установлено, что при вышеуказанных параметрах гомогенизации молока возможность реактивации фермента снижается (коэффициент корреляции составляет – 0,94). Следовательно, гомогенизация вызывает такие изменения в молекуле щелочной фосфатазы, которые, не повышая ее активности, изменяют структуру молекулы таким образом, что она теряет способность к восстановлению после тепловой обработки молока.
Установлено, что гомогенизация сырого цельного молока при давлении ≤200 МПа при 20°С неадекватна высокотемпературной пастеризации в части инактивации щелочной фосфатазы. Однако частичная инактивация может иметь место. Этот фермент устойчив и к более высокому давлению, например, после 400 МПа в течение 60 мин при 20°С, хотя степень инактивации, как правило, увеличивается (Haues М. G., Kelly А. L., 2003).
Двуступенчатая гомогенизация молока ≈ 3,5 и 14,1 МПа соответственно вызывает освобождение из ОШЖ ≈ 5 % сфингомиелинфосфодиэстеразы I и ≈ 40 и 50 % 5'-нуклеотидазы и кислой фосфатазы соответственно.
Установлено определенное влияние гомогенизации на активность нативных протеиназ молока – плазмина и плазминогена (табл. 61).
Таблица 61
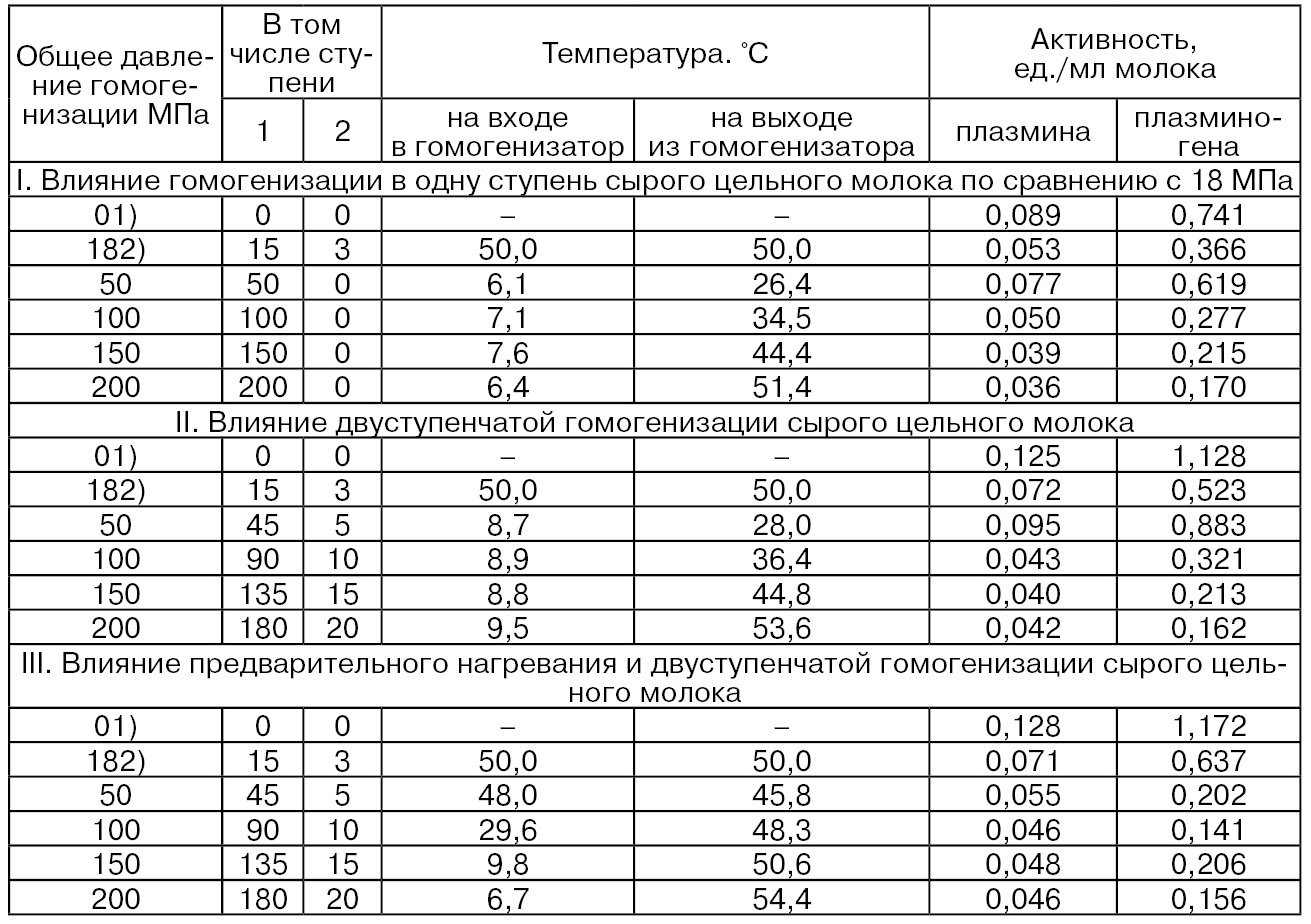
1) Негомогенизированное сырое молоко (контроль), жир ≈ 4,0 %.
2) Гомогенизация при 18 МПа.
Из табл. 61 видно, что плазминоген был более чувствителен к высоким давлениям гомогенизации, чем плазмин, как без, так и с предварительным нагреванием молока. Так, при различных способах гомогенизации снижение активности плазмина, по сравнению с контролем, составило ≈ 2,5...3 раз, а плазминогена от ≈ 4,4 до 11 раз. При этом снижение активности плазмина незначительно зависело от вида гомогенизации и нагревания, в то время как активность плазминогена снижалась в заметно большей степени (≈ 7 и 11 раз) при двуступенчатой гомогенизацией без и с нагреванием молока, по сравнению с одноступенчатой (≈ 4,4 раз). Снижение активностей этих двух протеиназ происходит благодаря участию молочных белков, в том числе казеина, в создании новых оболочек жира, в результате чего структура казеина частично нарушается, что может иметь дестабилизирующее влияние на активности плазмина и плазминогена, а также благодаря сильному механическому воздействию на эти ферменты (Hayes М. G., Kelly A. L., 2003).
В противоположность рассмотренным выше ферментам, на активность которых определенно влияет гомогенизация молока, активность аденозиндеаминазы, практически, не изменяется при гомогенизации молока, нагретого до 65 °С (рис. 47).
Рис. 47. Влияние гомогенизации на активность аденозиндеаминазы (Martin D., Kiesner С. et al., 1998):
1 – сырое молоко; 2 – пастеризованное молоко (65 °С)
Таким образом, вследствие гомогенизации молока при параметрах, обычно используемых в производстве или значительно больших для случаев альтернативы тепловой обработке, структура и местоположение молекул ферментов изменяется, что отражается на тех или иных их свойствах. В целях предотвращения повышения активности, например, ксантиноксидазы, липазы и протеиназ молоко следует подвергать гомогенизации только до его пастеризации.
Не следует гомогенизировать молоко повторно и смешивать сырое негомогенизированное молоко с гомогенизированным.