Поскольку гидроколлоиды в индустрии продуктов питания относят к группе пищевых добавок, то наиболее широко распространенной международной системой контроля безопасности гидроколлоидов является система, учрежденная Совместной конференцией по пищевым добавкам ФАО/ВОЗ – FAO/WHO (FAO – Food, and Agriculture Organization of the United Nations – Продовольственная и сельскохозяйственная организация при ООН; WHO – World Health Organization – Всемирная организация здравоохранения), состоявшейся в сентябре 1955 г. В соответствии с рекомендациями эти две организации должны собирать и распространять информацию о пищевых добавках. С этого времени Объединенным комитетом экспертов по пищевым добавкам JECFA (Joint Expert Committee on Food Additives) было определено качество более 600 веществ, разработана классификация по наименованиям и чистоте продуктов.
Комитет JECFA был создан в середине 1950-х гг. организациями ФАО и ВОЗ для оценки свойств химических добавок в пищевых продуктах в соответствии с международными стандартами. В начале 1960-х гг. была создана международная межправительственная организация – Комиссия «Кодекс Алиментариус» (Codex Alimentarius Commision – САС), главной задачей которой является защита здоровья потребителя, а также помощь в распространении продукции на международном рынке. После организации САС было принято решение, что JECFA будет выступать в роли советника-эксперта для САС в отношении пищевых добавок. Была установлена система, посредством которой Кодексный комитет по пищевым добавкам и контаминантам (Codex Committee on Food Additives and Contaminants – CCFAC), являющийся главным подкомитетом, будет определять, каким пищевым добавкам должно быть уделено приоритетное внимание.
Перед включением добавок в стандарты Пищевого кодекса (Codex Food Standards) они отсылаются на рассмотрение и оценку в JECFA. Приглашенные в качестве членов JECFA специалисты являются независимыми экспертами и не представляют интересы своего правительства или своих работодателей. Комитетом экспертов устанавливаются безопасные уровни использования пищевых добавок и разрабатываются стандарты, позволяющие идентифицировать и определить степень чистоты пищевых добавок. Отчеты заседаний JECFA публикуются в выпусках технических отчетов ВОЗ (WHO Technical Report Series). В выпусках о пищевых добавках, издаваемых ВОЗ (WHO Food Additive Series), публикуются обзоры токсикологических исследований, которые обобщают данные, являющиеся основой для установления критериев безопасности продуктов. Характеристики продуктов описываются в выпусках, посвященных продуктам и питанию, издаваемых ФАО (FAO Food and Nutrition Paper Series).
Таким образом, задача JECFA сводится к определению свойств рассматриваемой пищевой добавки и рекомендациям по ее внедрению, которые направляются Кодексному комитету, занимающемуся пищевыми добавками и контаминантами (CCFAC).
Если на пленарном заседании эта добавка одобряется всеми странами-участницами, ее свойства подтверждаются Комиссией «Кодекс Алиментариус».
Конечным этапом является включение этой добавки в Общий стандарт по пищевым добавкам (Codex General Standard for Food Additives). Эта процедура может быть очень длительной и дорогостоящей, так как все заинтересованные участники могут придерживаться разных точек зрения и вносить различные дополнения.
После ее утверждения добавка распространяется по всему миру.
Более детально эти процедуры описаны в Общих требованиях (General requirements) САС.
Основными критериями безопасности пищевых добавок и, соответственно, пищевых гидроколлоидов являются: острая токсичность, метаболизм и токсикокинетика, генотоксичность, репродуктивная токсичность и тератогенность, субхроническая и хроническая токсичность, канцерогенность.
Последовательность оценки токсикологической безопасности пищевых добавок представлена на рис. 1.1.

Рис. 1.1. Оценка токсикологической безопасности пищевых добавок
Отдельные исследования часто проводят одновременно, например изучение токсичности проводят совместно с исследованием канцерогенности.
Гигиеническое регламентирование пищевых добавок в продуктах и рационе питания осуществляется в четыре этапа.
Первый этап – проведение предварительной токсиколого-гигиенической оценки регламентируемого химического вещества. На основании сведений, представляемых разработчиком, определяют рациональное и товарное название химического вещества, его назначение, технологию получения, химическую структуру или химический состав, содержание примесей, его физико-химические свойства. Устанавливают наличие и характеристику методов количественного определения пищевой добавки в пищевых продуктах и различных средах, в том числе микроколичеств в биосредах. Определяют область и масштабы применения пищевой добавки, ее возможное распространение в окружающей среде, особенности миграции в различных звеньях трофических цепей и загрязнения пищевых продуктов. Ориентировочно рассчитывают те дозы пищевой добавки, которые могут в реальных условиях поступать в организм с пищей. На основании этих данных составляют программу дальнейших исследований пищевой добавки.
Первичную токсикологическую характеристику пищевой добавки получают в эксперименте на острую токсичность, в котором на двух- трех видах модельных животных определяют летальную дозу (ЛД50) и описывают признаки интоксикации.
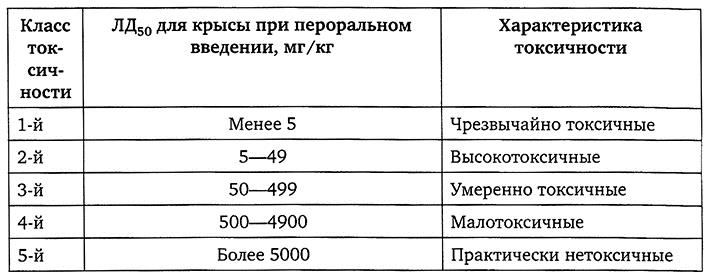
ЛД50 – доза, при которой погибает 50% подопытных животных. Она характеризует острую токсичность исследуемого вещества. Чем выше значение ЛД50, тем меньше острая токсичность вещества. Животных наблюдают не менее 1-2 недель, в течение которых оценивают степень опасности вещества (табл. 1.1).
Таблица 1.1
Летальная доза вещества (ЛД50) в зависимости от его токсичности
Зная ЛД50, расчетным путем можно прогнозировать пороговую или подпороговую дозу вещества в эксперименте на хроническую токсичность. Для этого применяют следующую формулу:
1gМНД = 0,91g ЛД50 – 3,6, (1.1)
где МНД – максимально недействующая доза в эксперименте на хроническую токсичность, составляющая обычно примерно 0,1 пороговой дозы, мг, на 1 кг массы тела.
Помимо установления класса острой токсичности на первом этапе исследования пищевой добавки определяют также ее метаболизм и токсикокинетику. Для этого трем группам модельных экспериментальных животных вводят ежедневно перорально по 1/5, 1/10 и 1/20 части ЛД50 в течение 1-2 мес.
Чтобы проследить путь вещества в организме, изучают пищеварение и выделение самого вещества и его метаболитов в биологических жидкостях, в органах и тканях. С помощью повышенных доз выясняют зависимость метаболизма от дозировки. Устанавливают, в каком органе или ткани происходят биохимические превращения исследуемого вещества и как они зависят от дозы и времени.
Для получения более достоверных данных подопытным животным иногда вводят исследуемое вещество, меченое радиоактивным изотопом 14С. При исследовании метаболизма и токсикокинетики регистрируют гибель животных и рассчитывают время гибели 50% животных в каждой группе.
Коэффициент кумуляции К рассчитывают по формуле
К = суммарное количество ЛД50(n)/ЛД50, (1.2)
где ЛД50–средняя эффективная доза, вызвавшая гибель 50% подопытных животных; суммарное количество ЛД50(п) – суммарное количество дробных доз, введенных животным до гибели 50% из них, выраженное в ЛД50.
Особое внимание уделяют на этом этапе исследования изучению механизма кумуляции, так как в одних случаях в организме происходит накопление самого вещества (материальная кумуляция); в других – эффект действия вещества суммируется (функциональная кумуляция).
Сверхкумулятивными свойствами обладают вещества, имеющие коэффициент кумуляции менее 1;отК=1доК=3 вещества обладают выраженной кумуляцией; от К = 3 до К = 5 – умеренной, и при К > > 5 вещества относят к группе веществ со слабой кумуляцией. Наиболее опасными считаются вещества, у которых коэффициент кумуляции меньше в группе животных, получавших меньшие доли ЛД50.
Второй этап исследования пищевой добавки является основным. В результате проведения эксперимента на хроническую токсичность определяют пороговую и максимально недействующую дозы пищевой добавки по общетоксическому действию. Для этого используют два вида модельных лабораторных животных, в организме которых метаболизм изучаемого химического соединения идентичен метаболизму человека. Длительность эксперимента составляет обычно 9-18 мес. Изучают влияние дозы, полученной в остром эксперименте и рассчитанной по формуле в расчете на 1 кг массы тела животного, а также дозы, в 5-10 раз меньшей и в 10 и 100 раз большей.
По окончании эксперимента на хроническую токсичность у подопытных животных (3-4 поколения) и контроля делают вывод о наличии или отсутствии у пищевой добавки генотоксичной, репродуктивной, субхронической и хронической токсичности.
Под генетической токсичностью вещества понимают его способность оказывать вредное воздействие на наследственность, т.е. вызывать нежелательные мутации. Различают генные, хромосомные и геномные мутации.
Для проверки на мутагенность используются как тесты in vitro – с микроорганизмами, так и тесты in vivo – с растениями, насекомыми и грызунами.
С общетеоретических позиций влияние пищевых добавок на мутагенез может быть сведено к трем основным проявлениям:
1) пищевая добавка может усиливать спонтанный мутагенез, т.е. являться мутагеном; пищевая добавка может усиливать эффекты мутагенов, присутствующих во внешней среде, т.е. обладать комутагенной активностью; пищевая добавка может ослаблять мутагенные эффекты, т.е. проявлять антимутагенные свойства.
Очевидно, что пищевые добавки с мутагенными и комутагенными свойствами представляют опасность для жизни и здоровья человека, тогда как на основе пищевых добавок с антимутагенными свойствами возможна разработка продуктов, способных снижать «генетический риск» воздействия мутагенов на генетические структуры человека.
Исследования на репродуктивную токсичность включают проверку влияния исследуемого вещества на мужскую и женскую плодовитость и общую способность к продолжению рода, на внутри- и послеутробное развитие, а также выяснение наличия у него тератогенных свойств.
Под тератогенностъю вещества понимают его способность вызывать появление уродств у эмбрионов. Тератогены принципиально недопустимы в качестве добавок в продуктах питания.
Для исследования субхронической токсичности доза исследуемого вещества должна быть выбрана так, чтобы, с одной стороны, токсическое действие было заметно, с другой – подопытные животные остались живы. Исследуемое вещество вводят в рацион животных в течение 3–6 мес. в нескольких дозах. Опыты по субхронической токсичности включают исследования живых животных и их трупов (по окончании исследования). Результаты оценки субхронической токсичности служат для оценки диапазона доз и способа введения вещества в организм при изучении хронической токсичности.
Под хронической токсичностью понимают отрицательное действие, которое может быть выявлено после потребления исследуемого вещества в течение двух лет и более. Отрицательное действие может быть выражено в канцерогенезе или возрастной восприимчивости определенной ткани. Поэтому исследования по определению хронической токсичности рассматриваются как важный элемент оценки потенциального риска пищевой добавки.
В результате оценки хронической токсичности исследуемого вещества определяют уровень (дозу) потребления добавки, при котором не обнаруживается никакого отрицательного действия. Он называется уровень, не вызывающий наблюдаемого действия (no-observed-effectlevel – NOEL), представляет собой наивысшую дозу, не оказывающую токсического действия, и служит основой для установления допустимого (уточного потребления – ДСП.
Отношение дозы вещества, безопасной в долгосрочных токсикологических опытах, к концентрации его в продукте питания называется степенью реальной безопасности.
На третьем этапе исследований обобщают результаты проведенных исследований и обосновывают допустимую суточную дозу (ДСД) и допустимое суточное потребление (ДСП) пищевой добавки, ее предельно допустимую концентрацию (ПДК) в пищевых продуктах.
Для определения ДСД максимально недействующую дозу (МНД) или дозу NOEL делят на коэффициент запаса. Объединенный комитет экспертов ФАО/ВОЗ по пищевым добавкам JECFA во избежание неучтенных факторов рекомендовал использовать интегральный коэффициент запаса, равный 100. Определив ДСД, рассчитывают ДСП для взрослого человека (масса тела 60 кг) – ДСП = 60ДСД мг/сут. и для ребенка (масса тела 30 кг) – ДСП = 30ДСД мг/сут. Обоснование ДСД чрезвычайно трудоемко и требует 3-5 лет.
В тех случаях, когда JECFA считает, что токсикологическая безопасность вещества выяснена еще недостаточно, устанавливается временное ДСП. Существенные составляющие продуктов питания и малотоксичные пищевые добавки имеют неограниченное ДСП. Если в токсикологической безопасности уже разрешенного вещества появляются сомнения, то статус его ДСП понижается с постоянного до временного и проводятся дополнительные исследования.
Зная величину ДСП, можно рассчитать ПДК (мг/кг):
ПДК = ДСП/Р, (1.3)
где Р – количество продуктов в суточном рационе, в которых может содержаться регламентируемая пищевая добавка, кг.
При этом количество продукта в пищевом рационе принимают из рекомендованных в стране средних величин суточного рациона (стандартный рацион). В величину Р включаются только те продукты, в которых может содержаться регламентируемая пищевая добавка, т.е. Р = Р1 + Р2 + Р3 + ... .
Однако такой способ расчета применим только в том случае, если пищевая добавка находится в продуктах питания примерно в одинаковой концентрации. В противном же случае ПДК в каждом продукте, в котором может содержаться пищевая добавка, определяют по формуле (мг/кг)
![]()
где ПС – прогнозируемое или фактическое содержание регламентируемой пищевой добавки в данном виде продукта (в процентах к ДСД или общему содержанию ксенобиотика в продуктах); М – масса данного вида продукта в стандартном суточном рационе, кг.
Установив ПДК пищевой добавки для продукта, по токсикологическому показателю вредности выясняют, не оказывает ли эта концентрация неблагоприятного влияния на органолептические качества продукта и его пищевую ценность. В случае необходимости вносят коррективы, т.е. снижают ПДК.
После того как ПДК утверждена органами здравоохранения и пищевая добавка широко используется в пищевой промышленности, наступает четвертый этап – наблюдение за ней, чтобы подтвердить безопасность использования и, если требуется, внести поправку в гигиенические нормативы. Пищевые добавки, являющиеся и считающиеся традиционно безопасными, называют GRAS-веществами (generally recognized as safe).
Наличие пищевых добавок, как и пищевых гидроколлоидов, в продуктах питания, как правило, должно указываться на потребительской упаковке, этикетке, банке, пакете и в рецептуре.
Процедуры комиссии «Кодекс Алиментариус» отражены также в сборниках унифицированных, принятых странами-участницами пищевых стандартов. После утверждения добавки ей присваивается идентификационный номер, который является показателем признания ее безопасности.
Следует отметить, что вопросы применения пищевых добавок, которые находятся на стадии определения их свойств экспертами JECFA, остаются в ведении этого комитета до тех пор, пока рассматриваемые добавки не будут официально признаны Кодексом. Так, например, гуммиарабик – пищевой гидроколлоид, который широко используется на протяжении уже более 2000 лет, окончательно полную кодексную спецификацию получил только в июне 1999 г.







