В настоящее время БАД занимают одно из первых мест на рынке пищевых продуктов как по торговой массе, так и по денежному эквиваленту.
Разработка технической документации на новые виды БАД осуществляется в соответствии с ТР ТС 021/2011 «О безопасности пищевой продукции», ГОСТ Р 51074-2003 «Продукты пищевые. Информация для потребителя. Общие требования»; Методическими указаниями МУК 2.3.2.971-00 «Порядок санитарно-эпидемиологической экспертизы и технических документов на пищевые продукты».
Разрешение на производство БАД оформляется органами и учреждениями Госсанэпидслужбы при соблюдении санитарных норм и правил. При этом регламент осуществления Госсанэпиднадзора определен МУК 2.3.2.721-98 «Определение безопасности и эффективности биологически активных добавок к пище».
Лавинообразное появление на рынке отечественных и зарубежных БАД диктует необходимость их контроля, дифференцированной оценки и характеристики, такая информация представляется важной как для специалистов, так и для потребителей.
Государственный надзор за производством БАД осуществляется центрами Госсанэпиднадзора в соответствии с Федеральным законом от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения», Федеральным законом от 02.01.2000 № 29-ФЗ «О качестве и безопасности пищевых продуктов» и Положением о Государственной санитарно-эпидемиологической службе Российской Федерации, утвержденным постановлением Правительства РФ от 24.07.2000 № 554.
Порядок осуществления производственного контроля, методы анализа качества и безопасности БАД определяются органами и учреждениями Госсанэпиднадзора в соответствии с технической документацией на отдельные виды БАД, МУК 2.3.2.721-98 «Определение безопасности и эффективности биологически активных добавок к пище», СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов», ТР ТС 021/2011«0 безопасности пищевой продукции».
Головной организацией по проведению экспертных исследований БАД является НИИ питания РАМН. Созданный для этих целей компьютеризированный банк данных включает: сведения о фирме и стране-производителе, содержании активных компонентов БАД, направленности их действия, форму выпуска продукта и способы его употребления. Проводится классификация БАД по каждому из представленных параметров, отслеживается возможное дублирование продукции, выявляются тенденции в расширении ассортимента, что имеет практическое значение при разработке новых препаратов.
Первичные данные оформляются в виде экспертного заключения, которое передается НИИ питания РАМН в Госкомсанэпиднадзор России для выдачи гигиенического заключения.
В информационно-аналитическом центре Госсанэпиднадзора создана автоматизированная поисковая аналитическая система «SERTI», позволяющая производить выработки и обобщать имеющиеся данные о БАД.
Порядок государственной регистрации БАД определен приказом Минздрава России от 15.04.1997 № 117 «О порядке экспертизы и гигиенической сертификации биологически активных добавок к пище», приказом Минздрава России от 26.03.2001 № 89 «О государственной регистрации новых пищевых продуктов, материалов и изделий, парфюмерной и косметической продукции, средств и изделий для гигиены полости рта, табачных изделий», постановлением от 17.04.2003 № 50 Главного государственного санитарного врача Российской Федерации о введении в действие санитарно- эпидемиологических правил и нормативов СанПиН 2.3.2.1290-03 «Гигиенические требования к организации производства и оборота биологически активных добавок к пище (БАД)».
В настоящее время определены гигиенические требования к организации производства и оборота биологически активных добавок к пище (СанПин 2.3.2.1290-03).
С учетом имеющегося мирового и отечественного опыта в России разработана Система контроля за производством и реализацией БАД. На основе действующих нормативных документов определена методология оценки потребительских свойств БАД, определяющих их качество и безопасность [20].
Выбор показателей товарной экспертизы отдельных групп специализированных продуктов должен основываться на индивидуальных особенностях, характеризующих органолептические, физико-химические свойства, функциональную направленность, роль и место в питании современного человека/Эту позицию разделяют многие отечественные и зарубежные специалисты в области питания и товароведения продовольственных товаров, в том числе функционального назначения.
Что касается БАД, то в основу выбора показателей товарной экспертизы положены нормативные документы Минздрава России и технические регламенты Таможенного союза.
На рис. 2.7 представлены основные составляющие товарной экспертизы БАД.
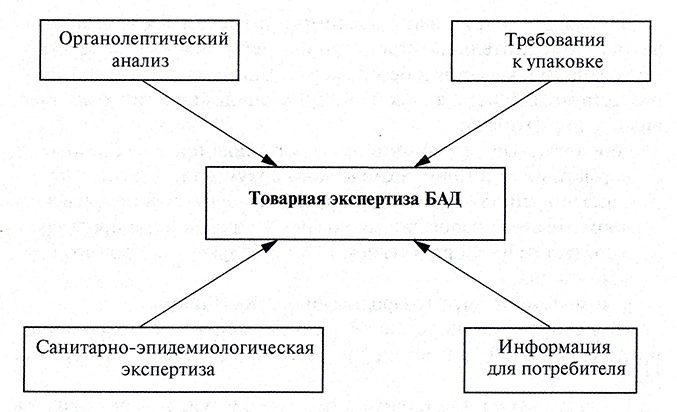
Рис. 2.7. Основные составляющие товарной экспертизы БАД
Основной частью товарной экспертизы БАД являются показатели санитарно-эпидемиологической экспертизы, состоящие из следующих процедур:
- первичная экспертная оценка заявки, документов и материалов, характеризующих данную продукцию;
- определение потребности в проведении необходимых испытаний (в зависимости от полноты исходных сведений и особенностей БАД);
- проведение выполненного комплекса химических, микробиологических, токсикологических, других видов исследований и оценка их результатов с целью подтверждения безопасности и подлинности рассматриваемой продукции;
- экспериментальные исследования токсикологических, физиологических и метаболических эффектов, подтверждающих заявленную эффективность и безопасность БАД (при необходимости);
- клиническая оценка эффективности (при необходимости);
- оценка результатов экспериментальных и клинических испытаний и наблюдений;
- оценка методов исследований основных ингредиентов, действующих начал и подлинности БАД;
- подготовка и оформление экспертного заключения;
- подготовка и оформление регистрационного удостоверения.
Для нового или впервые вводимого в России БАД устанавливаются дополнительные процедурные действия на соответствие требованиям к качеству и безопасности (поскольку эти требования отсутствуют в действующих санитарно-эпидемиологических правилах и нормативах):
- обоснованные разработчиком нового вида продукта в проекте нормативного и (или) технического документа;
- согласно действующим санитарным правилам и гигиеническим нормативам к аналогичному по составу и свойствам продукту;
- в соответствии с предъявляемыми к продукту в стране его происхождения;
- рекомендуемые международными организациями.
При санитарно-эпидемиологической экспертизе БАД к пище, предназначенной для детей, предъявляются особые требования [44].
Органолептическая оценка БАД проводится, как правило, на первом этапе товарной экспертизы. Ее результаты могут быть основанием для отказа в регистрации или проведении дополнительных физико-химических и микробиологических исследований. В связи с этим данный метод постоянно совершенствуется исходя из специфики продукта [57].
Требования к упаковке БАД следующие:
- Упаковка БАД должна обеспечивать сохранность и качество БАД на всех этапах товарооборота.
- При упаковке БАД должны использоваться материалы, разрешенные для использования в установленном порядке для контакта с пищевыми продуктами или лекарственными средствами.
- Требование к информации, нанесенной на этикетку БАД, устанавливаются в соответствии с действующими законодательными нормативными документами, регламентирующими вынесение на этикетку информации для потребителя.
Информация для потребителя наносится на индивидуальную или транспортную упаковку и должна содержать:
- наименования БАД, в частности товарный знак изготовителя (при наличии);
- обозначения нормативной или технической документации, обязательным требованиям которых должны соответствовать БАД (для БАД отечественного производства и стран СНГ);
- состав БАД, с указанием ингредиентного состава в порядке, соответствующем их убыванию в весовом или процентном выражении;
- сведения об основных потребительских свойствах БАД;
- сведения о весе или объеме БАД в единице потребительской упаковки и весе или объеме единицы продукта;
- сведения о противопоказаниях для применения при отдельных видах заболеваний;
- указание, что БАД не является лекарством;
- дату изготовления, гарантийный срок годности или дату конечного срока реализации продукции;
- условия хранения;
- информацию о государственной регистрации БАД с указанием номера и даты;
- место нахождения, наименование изготовителя (продавца) и место нахождения и телефон организации, уполномоченной изготовителем (продавцом) на принятие претензий от потребителей.
Информация доводится до сведения потребителей в любой доступной для прочтения потребителем форме.
Использование термина «экологически чистый продукт» в названии при нанесении информации на этикетку БАД, а также использование иных терминов, не имеющих законодательного и научного обоснования, не допускается.
Что касается товарной экспертизы пищевых продуктов, обогащенных БАД, то первые попытки решения этой проблемы сделаны на примере безалкогольных напитков лечебно-профилактического назначения [70].
С учетом имеющегося опыта и новых нормативных документов определены основные составляющие товарной экспертизы пищевых продуктов, обогащенных БАД [26] (рис. 2.8).
Органолептические, физико-химические, микробиологические показатели качества и безопасности приводятся в соответствии с требованиями нормативных и технических документов.
Исследование стабильности обогащенных добавок проводится в процессе производства и хранения разрабатываемой продукции. В связи с этим особый интерес представляет использование поливитаминных и витаминно-минеральных премиксов, рецептуры которых разрабатываются рядом отечественных и зарубежных фирм (компания «Хоффманн-Ля Рош», Швейцария; ЗАО «Валетек продимпэкс», Россия; ЗАО «Сантоза Факторинг», Россия и др.) с учетом современных требований международных стандартов (Codex Alimentarius, ESPGAN).
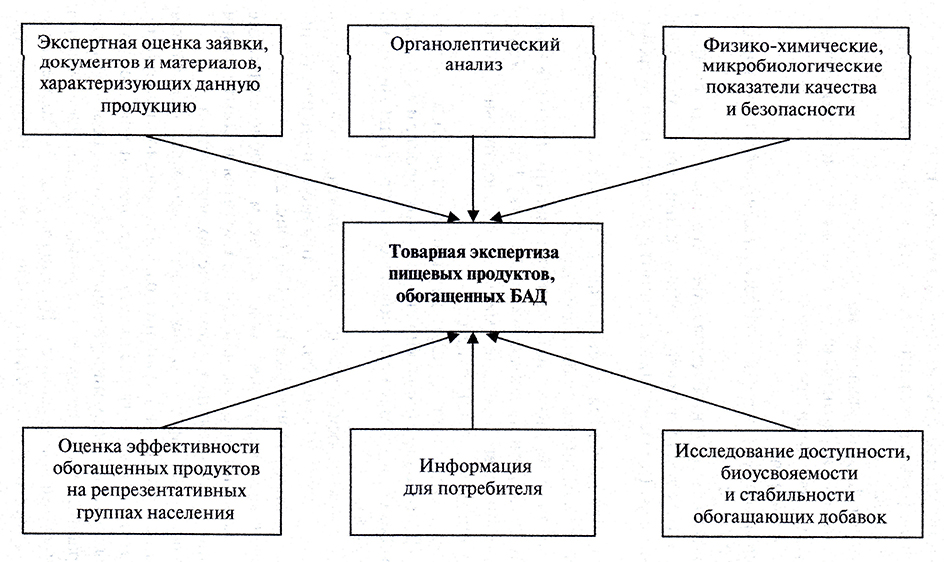
Рис. 2.8. Основные составляющие товарной экспертизы пищевых продуктов, обогащенных БАД
В рецептурах премиксов все витамины используются в виде специально разработанных вод о- или жирорастворимых форм, стабильность которых при некоторых видах технологической обработки и хранения (пастеризация, нагревание, интенсивное перемешивание, охлаждение и др.) максимальна. Указанные обстоятельства позволяют обеспечить высокую стабильность витаминов в процессе производства и хранения обогащенных продуктов.
Доступность и биоусвояемость вносимых добавок изучается, как правило, в эксперименте на животных.
Оценка эффективности обогащенных продуктов проводится в натурных наблюдениях. В зависимости от функциональной направленности продукта формируются репрезентативные группы населения с наличием контрольной группы людей. При этом используются специфические методы оценки эффективности действия обогащенного продукта и коррекции обменных нарушений.
При рассмотрении показателя информации для потребителя представляется важным вопрос о содержании микронутриентов в обогащенных ими продуктах питания.
В соответствии с практикой, принятой в настоящее время в большинстве стран, регламентируемое, т.е. гарантируемое производителем и объявляемое на упаковке (этикетке), содержание микронутриентов в обогащенном продукте должно быть достаточным для удовлетворения за счет этого продукта не менее 15-30% (оптимально 30-50%) от средней суточной потребности в этих микронутриентах при рекомендуемом уровне потребления данного продукта.
Указанный принцип исходит из того, что реальный дефицит микронутриентов, в частности витаминов и минеральных веществ, в обычном рационе современного человека находится в пределах 30-50% от их рекомендуемого уровня потребления. Следовательно, обогащенный в соответствии с этим принципом продукт позволяет эффективно восполнить имеющийся дефицит, поскольку остальные 50-70% необходимых витаминов и минеральных веществ поступают с другими входящими в рацион продуктами (обычными или обогащенными).
Важнейшее требование к внешнему оформлению обогащенных микронутриентами продуктов питания состоит в том, что регламентируемое содержание витаминов и минеральных веществ в обогащаемых ими продуктах должно быть указано на индивидуальной упаковке этого продукта, контролироваться как производителем, так и органами государственного надзора.
Регламентируемое содержание обогащающих микронутриентов должно выражаться в мг на 100 г или среднюю суточную порцию продукта. Для витаминов А, Е, D допускается выражение их содержания в международных единицах (МЕ). Для потребителя удобным и наглядным является выражение содержания витаминов и минеральных веществ в процентах от средней суточной потребности или рекомендуемой нормы потребления. На импортных продуктах и препаратах это выглядит как процент RDA (Recommended Dietary Allowances).
Ответственность перед потребителем за качество и эффективность БАД накладывает на их разработчиков и производителей исключительно важное обязательство: они должны гарантировать сохранность содержащихся в продукте регламентируемых биологически активных веществ, а также их доступность и биоусвояемость организмом человека в процессе потребления обогащенных ими продуктов питания, как это отмечено выше.







