В молоке других сельскохозяйственных животных содержатся различные ферменты. Они имеют как нативное, так и микробное происхождение. Местоположение их, как и в коровьем молоке, различно и определяется видом фермента.
Функции молочной железы с количественной и качественной сторон в зависимости от вида животного обусловливают некоторое различие в содержании и активности одних и тех же ферментов молока.
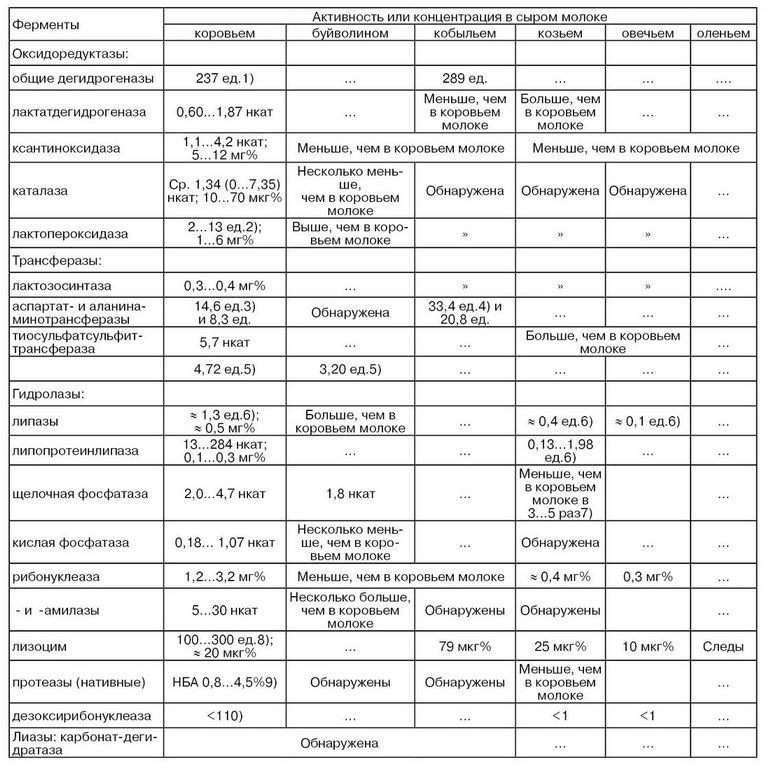
В табл. 17 представлены данные по активности или концентрации ферментов, обнаруженных в молоке различных сельскохозяйственных животных (троеточия означают отсутствие данных). Из класса оксидоредуктаз обнаружены некоторые дегидрогеназы, каталаза, лактопероксидаза и ксантиноксидаза (Kehagias С, Dalles Т., 1986).
Среди изоферментов лактатдегидрогеназы в кобыльем молоке преобладает форма 2 (Н3М), а в козьем, как и в коровьем молоке, – форма 1 (Н4) (Грачев И. И., Попов С. М., Скопичев В. Т.). В буйволином молоке активность лактопероксидазы выше, чем в коровьем молоке. Это важно в том отношении, что лактопероксидаза является одним из основных компонентов антибактериальной системы молока. В то же время активность ксантиноксидазы в молоке других видов животных по сравнению с коровьим молоком заметно ниже, что используется в качестве теста для дифференциации молока животных различных видов (Cerbulis J., Farrell Н. М., 1977; Monget D., Gelin М., Laviolette Р, 1979; Zikakis J. P., Wooters S. C, 1980).
Поскольку ксантиноксидаза в основном связана с ОШЖ молока, поэтому можно предположить прямую связь активности этого фермента с содержанием жира в молоке различных животных. Однако в козьем, овечьем, буйволином и особенно оленьем молоке, где содержание жира выше, чем в коровьем, активность этого фермента ниже. Следовательно, секреция жира у различных сельскохозяйственных животных не связана с активностью ксантиноксидазы в молоке.
Из трансфераз наибольший интерес представляет тиосульфатсульфиттрансфераза как источник очень важного компонента – тиоцианата, являющегося одним из факторов лактопероксидазо-антибактериальной системы молока. В козьем и овечьем молоке активность этого фермента превышает его активность в коровьем молоке (Shahani К. М., Harper W. J. et al.).
Установлено, что в коровьем молоке цельном по сравнению с кобыльим цельным молоком активность аланинаминотрансферазы почти в 2 раза ниже – 0,44 и 0,92 мкг пировиноградной кислоты/мг белка молока соответственно 2,91 и 1,85%. Почти такое же соотношение активностей характерно и для аспартатаминотрансферазы – 1,15 и 0,69 (Ильясов И. З., Шахниев А. А.).
Важнейший гидролитический фермент молока – липаза, как было отмечено выше, в основном связана с мицеллами казеина. Поэтому можно предположить, что с повышением содержания казеина в молоке активность липазы должна увеличиваться, как в буйволином молоке. Однако активность липазы в козьем и особенно овечьем молоке значительно ниже – соответственно в ≈ 3 и 13 раз, чем в коровьем молоке, тогда как содержание казеина в молоке этих животных выше (Shahani К. М., Harper W. J. et al.). Таким образом, видимо, в основном более важным фактором в секреции как ксантиноксидазы, так и липазы является количество секретируемого молока, а не содержание белка или жира в нем (гл. 2).
Сравнение щелочной фосфатазы овечьего и коровьего молока показывает, что по кинетическим характеристикам, функциональным группам активного центра и широкой специфичности они полностью идентичны (Linden G., Alais С., 1978).
Кислая фосфатаза, выделенная из козьего молока, имела удельную активность около 8,2 Е/мг белка и молекулярную массу 43 000 Да (Kuzuya Y., Tanahashi Т., Kanamaru Y., 1979). Сравнение этого фермента козьего и коровьего молока показывает близость их молекулярных масс и одинаковое влияние на их активность некоторых активаторов и ингибиторов.
В молоке коз, овец и буйволиц рибонуклеазы содержится от 2 до 10 раз меньше, чем в коровьем молоке. Это может стать одной из причин, повышающих стабильность жировой фазы молока этих животных. Вместе с тем показано, что содержание рибонуклеазы в молоке египетских коров и буйволиц составляет ≈ 22,6 и ≈ 16,0 мг% соответственно (Ismail А. A., Ahmed N. S., Khorshid М.А., 1977).
В кобыльем молоке содержание лизоцима во много раз превышает его количество в коровьем молоке. Такое высокое содержание лизоцима указывает на то, что кобылье молоко обладает наиболее выраженным неспецифическим иммунитетом.
Таблица 17
1) 1 ед. соответствует образованию формазана, мкг/мг белка молока.
2) 1 ед. соответствует количеству фермента, вызывающего изменение оптической плотности смеси молока с n-фенилендиамин дигидрохлоридом на 1 ед. в течение 1 мин при 490 нм при 20 °С.
3) 1 ед. соответствует количеству фермента, вызывающего превращение 1 мг аминокислоты в 100 мл обезжиренного молока в течение 1 ч при 37 °С.
4) 1 ед. соответствует образованию пировиноградной кислоты, мкг/мл молока при стандартных условиях анализа.
5) 1 ед. соответствует количеству фермента, вызывающее образование 1 мкмоля γ-глютамингидроксамата в течение 1 ч в условиях опыта.
6) 1 ед. соответствует количеству фермента, вызывающего образование 1 мкэкв/СЖК/мл молока/мин при 37 °С.
7) Например, активность фермента, выраженная в мкг фенола/0,5 мл молока, составляет в среднем в козьем – ≈ 300, по сравнению с коровьим молоком ... 1750.
8) 1 ед. соответствует количеству фермента, вызывающего снижение на 0,001 оптической плотности смеси молока и суспензии M. lysodeikticus в течение 1 мин при 37 °С.
9) НБА – небелковый азот, % от общего азота.
10) Диффузная ед./0,1 мл.







